
Invasiva infektioner med betahemolyserande grupp A-streptokocker (iGAS) – Kunskaps- och diskussionsunderlag
Sammanfattning
Folkhälsomyndigheten har tagit fram ett kunskaps- och diskussionsunderlag som syftar till att sammanfatta epidemiologi av fall av invasiva infektioner orsakade av betahemolyserande grupp A-streptokocker (iGAS) och diskutera möjliga åtgärder inom olika tillämpningsområden för att förebygga sådana infektioner. I underlaget presenterar vi även identifierade kunskapsluckor. Underlaget är tänkt som utgångspunkt för planering av fortsatt gemensamt arbete på nationell nivå med att ta fram kunskapsstöd, till exempel vägledningar och information till prioriterade verksamheter och allmänheten. Det riktar sig därför främst till specialistföreningar, organisationer och myndigheter som är viktiga i arbetet med att förebygga sådana infektioner.
I underlaget beskriver vi det epidemiologiska läget av iGAS i Sverige och andra länder som övervakar iGAS. Det innehåller också en fördjupad deskriptiv analys av epidemiologin i Sverige säsongerna 2015–2025. Sedan iGAS började övervakas 2004 har trenden varit långsamt ökande. Antalet fall minskade under pandemin med covid-19, sannolikt relaterat till restriktionerna. Motsvarande pandemipåverkan noterades också för andra infektionssjukdomar såsom influensa och vattkoppor. Efter pandemin ökade antalet fall kraftigt. Säsongerna 2022–2023 och 2023–2024 hade Sverige, liksom flera andra höginkomstländer, ovanligt många fall av iGAS. Antalet fall var 2024–2025 tillbaka på en liknande nivå som före pandemin.
Betahemolyserande grupp A-streptokocker (GAS) sprids huvudsakligen från smittade personer via droppsmitta från luftvägarna eller genom direktkontakt. Indirekt kontakt via föremål anses som en möjlig men inte lika betydelsefull spridningsväg. GAS kan orsaka alltifrån lindriga infektioner till livshotande, invasiv sjukdom, iGAS. Bärarskap av GAS förekommer och är vanligast hos barn. Hur länge en person är bärare av GAS är osäkert. Hur stor betydelse bärare har för smittspridningen i befolkningen är oklart. Personer med symtomatisk halsinfektion bedöms vara mer smittsamma än bärare. Spridning inom hushåll och till nära kontakter från personer med halsinfektion orsakad av GAS är vanligt.
Det finns flera faktorer som förknippas med ökad risk för iGAS. Värdfaktorer, bakteriens genotyp samt förekomst av samtidig eller föregående infektion med virus anses alla vara viktiga för att iGAS ska utvecklas. Äldre, gravida, nyförlösta, nyfödda, personer med skadligt bruk av alkohol eller narkotika, hemlösa och personer med vissa kroniska sjukdomar löper ökad risk.
I tempererade områden och höginkomstländer har GAS-infektioner en säsongsvariation med topp under vårvintern. Infektionerna har beskrivits främst utgöras av halsfluss (faryngotonsillit) och scharlakansfeber (scarlatina). Förekomsten av iGAS samvarierar med dessa infektionstyper. Hud- och mjukdelsinfektioner orsakade av GAS beskrivs inte i dessa publikationer. I tropiska områden är svinkoppor (impetigo) och andra hudinfektioner vanligare bland GAS-infektioner och förekommer tillsammans med halsfluss och scharlakansfeber.
De flesta fall av iGAS är sporadiska, i undantagsfall syns kluster av fall. I utbrottsbeskrivningar finns rapporterat relaterade fall av iGAS där fallens insjukningsdatum skiljer sig med flera månader. Samma stammar av GAS kan orsaka både lindrig infektion och svårt livshotande infektion. Smittspårning runt fall av samhällsförvärvad iGAS bedöms därmed endast förebygga en liten andel av fallen, och nya sporadiska fall som saknar koppling till kända iGAS-fall kommer kunna uppstå.
Avgränsade utbrott och smittspridningar av lindriga GAS-infektioner och iGAS förekommer i olika miljöer, som sjukhusvård (ofta inom obstetrik och kirurgi), äldrevård och förskole- och skolverksamhet. I dessa miljöer har olika typer av GAS-infektioner, liksom bärarskap av GAS identifierats. Här kan det vara särskilt motiverat med vägledning för att förebygga iGAS. När det gäller åtgärder har information och utbildning, smittspårning, genomgång av hygienrutiner och antibiotikaprofylax till riskgrupper beskrivits.
I underlaget presenterar och diskuterar vi möjliga åtgärder att ta ställning till i ett vidare nationellt arbete med att ta fram kunskapsstöd till olika målgrupper. Listade åtgärder ska således inte ses som rekommendationer. Vi har bedömt evidens och allmänt kunskapsläge i fråga om effekt mot iGAS för nedanstående möjliga åtgärder.
Den översiktliga litteraturgenomgången visar att evidensläget för samtliga diskuterade åtgärder för att minska smittspridning i samhället är svagt. En viktig förklaring till detta är sannolikt att det är svårt att utforma och genomföra studier som tydligt visar på en effekt för enskilda åtgärder mot smittspridning.
Diskuterade möjliga åtgärder att ta ställning till i ett fortsatt nationellt arbete:
Organisatoriska åtgärder på myndighetsnivå för information, samordning och övervakning
- Använd optimala informationskanaler för att sprida smittskyddsinformation till olika målgrupper.
- Utarbeta samarbetsrutiner med de aktörer som ansvarar för viktiga informationskanaler för smittskyddsinformation.
- Utvärdera och överväg att förändra epidemiologisk och mikrobiell övervakning av iGAS.
Åtgärder kring sjukdomsfall som syftar till att minska smittspridning
- Minimera kontakt mellan infekterade och friska.
- Bryt smittvägar.
- Smittspårning och uppföljning av iGAS-fall
- Antibiotikaprofylax till riskgrupper runt iGAS-fall
- Anpassning av diagnostik och behandling av misstänkta GAS-infektioner
Vaccination
- Vaccination mot GAS
- Vaccination mot vattkoppor och influensa.
Vi beskriver också några verksamhetsområden, olika typer av verksamheter respektive hela samhället, som vi bedömer som särskilt viktiga i det fortsatta nationella arbetet för att förebygga iGAS. Vi har baserat valet av områden dels på etablerade riskgrupper, dels på beskrivningar av utbrott av och smittspridningar av GAS-infektion och iGAS.
Följande områden omfattas:
- Allmänheten, hela samhället
- Förlossning och nyföddhetsvård
- Förskola och skola
- Särskilt boende för äldre (SÄBO), hemtjänst och hemsjukvård.
Summary
The Public Health Agency of Sweden has produced a knowledge base report and discussion paper summarising the epidemiology of invasive infections caused by group A beta-haemolytic streptococci (iGAS) and discussing possible measures to prevent such infections. The report also presents identified knowledge gaps. It is intended as a starting point to plan continued collaborative work at the national level to develop knowledge support resources, such as guidelines and information for prioritised public services and the general public. The report is therefore primarily intended for specialist associations, organisations, and authorities that are important in the work to prevent these infections.
In the report, we describe the epidemiological situation of iGAS in Sweden and other countries that monitor iGAS. It also includes an in-depth descriptive analysis of the seasonal epidemiology in Sweden 2015–2025. Since iGAS monitoring began in 2004, the trend has been slowly increasing. The number of cases decreased during the COVID-19 pandemic, likely related to restrictions. A similar pandemic effect was also noted for other infectious diseases such as influenza and chickenpox. After the pandemic, the number of cases increased sharply. During the 2022–2023 and 2023–2024 seasons, Sweden, like several other high-income countries, had an unusually high number of iGAS cases. The number of cases in 2024–2025 reduced to a level similar to that before the pandemic.
Group A beta-haemolytic streptococci (GAS) are spread mainly from infected people via droplet transmission from the respiratory tract or through direct contact. Indirect contact via objects is considered a possible but less significant route of transmission. GAS infections can vary, from mild infections to life-threatening, invasive disease (iGAS). Carriage of GAS is most common in children. It is uncertain how long a person remains a carrier of GAS, and the significance of carriers to the spread of infection in the population is unclear. People with symptomatic throat infections are considered more contagious than carriers. Spread within households and to close contacts from people with GAS throat infections is common.
There are several factors associated with an increased risk of iGAS. Host factors, bacterial genotype, and the presence of concurrent or preceding viral infection are all considered important for the development of iGAS. The elderly, pregnant women, postpartum women, newborns, people with harmful use of alcohol or drugs, homeless people, and those with certain chronic diseases are at increased risk.
In temperate regions and high-income countries, GAS infections exhibit seasonal variation, peaking in late winter/early spring. These infections are primarily described as pharyngotonsillitis and scarlet fever. The occurrence of iGAS co-varies with these types of infections. Skin and soft tissue infections caused by GAS are not described in these publications. In tropical regions, impetigo and other skin infections are more common among GAS infections and occur alongside pharyngitis and scarlet fever.
Most cases of iGAS are sporadic; clusters are rare. Outbreak descriptions report related cases of iGAS where the onset dates differ by several months. The same strains of GAS can cause both mild infection and severe, life-threatening disease. Contact tracing around cases of community-acquired iGAS is therefore estimated to prevent only a small proportion of cases, and new sporadic cases without links to known iGAS cases will continue to arise.
Limited outbreaks and transmission of mild GAS infections and iGAS occur in various settings, such as hospital care (often in obstetrics and surgery), elderly care, preschools and schools. In these environments, different types of GAS infections, as well as GAS carriage, have been identified. Guidance to prevent iGAS may be particularly justified here. Described measures include information and education, contact tracing, review of hygiene routines, and antibiotic prophylaxis for risk groups.
In the report, we present and discuss possible measures to consider in broader national efforts to develop knowledge support resources for different target groups. The listed measures should not be seen as recommendations. We have assessed the evidence and general knowledge regarding the effectiveness of the following possible measures against iGAS.
The overview of the literature shows that the evidence for all discussed measures to reduce community transmission is weak. A likely important explanation for this is the difficulty in designing and conducting studies that clearly demonstrate the effect of individual measures on transmission.
Discussed possible measures to consider in continued national work:
Organisational measures at the national authority level for information, coordination, and monitoring
- Use optimal channels to spread infection control information to different target groups.
- Develop routines for collaboration with stakeholders responsible for important channels for infection control information.
- Evaluate and consider changing epidemiological and microbiological surveillance of iGAS.
Measures related to disease cases aimed at reducing transmission
- Minimise contact between infected and healthy individuals.
- Interrupt transmission routes.
- Contact tracing and follow-up of iGAS cases
- Antibiotic prophylaxis for risk groups around iGAS cases
- Adaptation of diagnostics and treatment of suspected GAS infections
Vaccination
- Vaccination against GAS
- Vaccination against chickenpox and influenza.
We also describe some public services and other social settings, that we consider particularly important in the continued national work to prevent iGAS. Our selection of settings is based partly on established risk groups and partly on descriptions of outbreaks and transmission of GAS infections and iGAS.
The following settings are covered:
- The general public, society as a whole
- Maternity and neonatal care
- Preschool and school
- Residential care homes for the elderly, home care, and home healthcare.
Ordlista och förkortningar
Cellulit – infektion i hudens djupare lager
Co-infektion – samtidig infektion, en person smittas av två eller flera olika smittämnen samtidigt
Emm-typning – metod för att karaktärisera GAS genom att analysera sekvensen av emm-genen, som kodar för M-proteinet på bakteriens cellyta
Erysipelas – rosfeber, typ av ytlig hudinfektion
Faryngit – halskatarr, inflammation i svalget
Faryngotonsillit – halsfluss, inflammation i tonsiller och svalg
GAS – betahemolyserande grupp A-streptokocker (Streptococcus pyogenes)
Helgenomsekvensering – metod för karakterisering av en organisms hela arvsmassa
iGAS – invasiv infektion orsakad av betahemolyserande grupp A-streptokocker
Impetigo – svinkoppor, typ av ytlig hudinfektion
Invasiv infektion – infektion där en mikroorganism trängt in i kroppsvätskor eller vävnader som normalt är sterila
Isolat – enskild bakterie som odlats fram och isolerats från en blandad bakteriepopulation
Klinisk manifestation – på vilket sätt en infektion eller sjukdom ger sig till uttryck eller framträder
Nekrotiserande fasciit (NF) – allvarlig mjukdelsinfektion med sönderfall av muskelvävnad
Oropharynx – munsvalget, mellersta delen av svalget belägen från munhålans gomsegel till tungbenet och struplocket
Patogenes – den process genom vilken en infektion leder till sjukdom
Perianal cellulit – stjärtfluss, infektion i hud och underliggande vävnad nära ändtarmsöppningen
Postpartum endometrit – infektion i livmodern efter förlossning
Puerperalsepsis – barnsängsfeber, infektion i samband med förlossning
Scarlatina – scharlakansfeber, infektion orsakad av GAS
Statistikdatum – det datum då ett fall först rapporteras i anmälningssystemet Sminet (antingen klinisk anmälan eller laboratorieanmälan)
Streptococcal toxic shock syndrome (STSS) – allvarlig iGAS-infektion med multiorgansvikt och chock
SÄBO – särskilt boende för äldre
Tonsillit – halsfluss, inflammation i tonsiller
Typning – metodik för karakterisering av bakterieisolat av samma art för att undersöka släktskap och egenskaper hos isolaten
Varicella – vattkoppor, infektion med varicella-zoster-virus
Om publikationen
Folkhälsomyndigheten har tagit fram det här kunskaps- och diskussionsunderlaget för att öka kunskapen om invasiva infektioner orsakade av betahemolyserande grupp A-streptokocker (iGAS). Underlaget sammanfattar översiktligt epidemiologi av iGAS-fall och möjliga förebyggande åtgärder inom olika tillämpningsområden.
Med utgångspunkt i underlaget kan olika kunskapsstöd tas fram till prioriterade verksamheter och allmänheten, dels av Folkhälsomyndigheten, dels i samarbete med olika aktörer som är viktiga i arbetet mot iGAS. Underlaget riktar sig i första hand till dessa aktörer.
Projektledare på Folkhälsomyndigheten har varit utredare Maria Egervärn. Följande personer på Folkhälsomyndigheten har medverkat till innehållet och deltagit i beredningen av ärendet: Olov Aspevall, Jessica Darenberg, Inga Fröding, Kate Lillepold, Barbro Mäkitalo och Anders Ternhag. I den slutliga handläggningen har också enhetschefen Alma Brolund deltagit.
Folkhälsomyndigheten
Erik Sturegård
Tillförordnad avdelningschef, tillförordnad statsepidemiolog, Avdelningen för smittskydd och beredskap
Bakgrund
Säsongerna 2022–2023 och 2023–2024 hade Sverige, liksom många andra höginkomstländer, ovanligt många fall av invasiva infektioner orsakade av betahemolyserande grupp A-streptokocker (iGAS). Antalet iGAS-fall i Sverige var 2024–2025 tillbaka på en liknande nivå som före pandemin med covid-19. Folkhälsomyndigheten har påbörjat ett arbete med det övergripande syftet att förebygga sådana infektioner, givet sjukdomens allvarlighetsgrad och som förberedelse inför en möjlig fortsatt långsiktig ökning av iGAS-fall.
Det här kunskaps- och diskussionsunderlaget är ett inledande arbete som:
- sammanfattar kunskapsläget översiktligt om infektioner med betahemolyserande grupp A-streptokocker (GAS) och iGAS
- beskriver det epidemiologiska läget av iGAS-fall
- diskuterar möjliga förebyggande åtgärder inom olika tillämpningsområden.
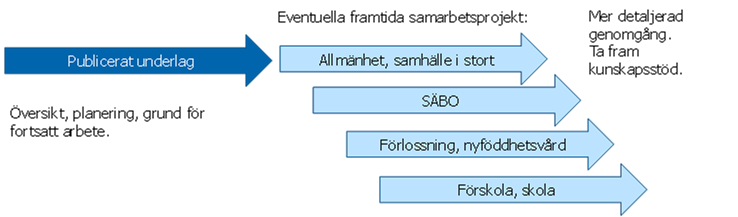
Underlaget är tänkt som en utgångspunkt för planering av fortsatt gemensamt arbete på nationell nivå med att ta fram olika kunskapsstöd om iGAS och andra GAS-infektioner till prioriterade verksamheter och allmänheten (figur 1). Underlaget presenterar även identifierade kunskapsluckor. I den del av underlaget som beskriver möjliga förebyggande åtgärder och områden har synpunkter från en extern referensgrupp tagits in. Deltagande aktörer redovisas i bilaga 1.
Diskussionen av åtgärder och områden i underlaget ska ses som förberedande för fortsatt arbete. Folkhälsomyndigheten och andra aktörer som vill utveckla stöd och vägledning för olika målgrupper behöver ta diskussionen vidare i framtida samarbetsprojekt. Underlaget riktar sig därför i första hand till de aktörer som är representerade i referensgruppen och andra aktörer som är relevanta i arbetet mot iGAS.
Figur 1. Schematisk bild över den tänkta processen för planering av fortsatt nationellt arbete med att ta fram olika kunskapsstöd i syfte att förebygga iGAS.
Metod
Disposition
Kunskaps- och diskussionsunderlaget är uppdelat i fyra delar:
- kortfattad introduktion om GAS-infektioner och iGAS – om smittämnet, olika infektionstyper och spridningsvägar
- sammanfattning av det epidemiologiska läget av iGAS-fall, en internationell utblick och en deskriptiv analys av svenska epidemiologiska data
- diskussion om möjliga åtgärder för att förebygga iGAS inom olika områden, för olika typer av verksamheter respektive hela samhället, som underlag för fortsatt nationellt arbete med relevant kunskapsstöd
- presentation av identifierade kunskapsluckor.
Avgränsningar
Underlaget ger inga rekommendationer om åtgärder för att förebygga iGAS. I stället presenteras och diskuteras möjliga åtgärder att ta ställning till i ett fortsatt nationellt arbete med att utarbeta konkret vägledning och information till olika målgrupper.
Diagnostik, behandling eller profylax med antibiotika berörs i den mån de bedöms ha relevans för smittskydd.
Litteratur och data
Underlaget är en översiktlig genomgång av vetenskaplig litteratur om GAS-infektioner och iGAS, med fokus på epidemiologi och förebyggande åtgärder. Underlaget har också tagit hänsyn till andra länders nationella riktlinjer om förebyggande av iGAS inom olika verksamhetsområden.
Sökningar gjordes juni–september 2025 i PubMed. En sökning efter översiktsartiklar de tio senaste åren om epidemiologin för GAS-infektioner kompletterades med olika, mer specifika sökningar efter originalartiklar inom fältet. Urvalet av den litteratur som användes gjordes utifrån (i) titel, (ii) sammanfattning och (iii) full text. Litteratur har också tagits fram via referenslistor i vetenskaplig litteratur och via explorativ sökning på webben.
Invasiv infektion med GAS (iGAS) är anmälningspliktigt enligt smittskyddslagen (2004:168). Fall rapporteras i anmälningssystemet Sminet av både behandlande läkare och laboratorium. Falldefinitionen revideras årligen (1; läs mer under Övervakning av iGAS i Sverige). Den statistik och efterföljande analys som presenteras i det här underlaget om det epidemiologiska läget för iGAS i Sverige baseras på uppgifter från Sminet, samt utdrag och samkörning mot register från Statistiska Centralbyrån (SCB), Skatteverket och Socialstyrelsen. Även data från Svebar, gällande fynd av GAS i svalgodlingar, har använts i underlaget. Svebar är ett nationellt it-system för övervakning av antibiotikaresistens, där all odlingsdata för bakterier och svampar har rapporterats från deltagande kliniska mikrobiologiska laboratorier i Sverige, för närvarande 22 av 26 laboratorier.
Antalet fall av iGAS i Sverige har fördelats på olika redovisningsgrupper och referenstider för att ge en överblick över omfattning, riskfaktorer, riskgrupper, riskmiljöer och variationer över tid. En djupare beskrivning av uppgiftskällor, datahantering och definitioner finns i bilaga 2.
GAS-infektioner och iGAS
Smittämnet
Betahemolyserande grupp A-streptokocker (GAS), eller Streptococcus pyogenes, är en vanlig orsak till infektioner. GAS är anpassade till människor. Andra värdar eller reservoarer bedöms inte viktiga för smittspridning (2).
GAS har många olika virulensfaktorer som möjliggör vidhäftning av bakterien, disseminering inom individen och smittspridning, genom att bland annat interagera med och störa immunförsvaret på följande sätt:
- M-protein och hyaluronsyrakapsel fäster bakterien vid värdceller och bidrar till att undvika immunförsvaret.
- Streptokinas och hyaluronidas möjliggör vävnadsinvasion.
- Streptokinas och DNaser degraderar immunförsvarsmolekyler.
- Superantigen och andra exotoxiner orsakar systemiska effekter och vävnadsskador, vilka särskilt ses vid allvarliga invasiva manifestationer (2, 3).
Infektionstyper
GAS orsakar sjukdom av varierande svårighetsgrad, från lindriga åkommor till livshotande sjukdom med snabbt förlopp.
Infektioner orsakade av GAS inkluderar bland annat:
- faryngotonsillit
- scharlakansfeber
- hud- och mjukdelsinfektioner (impetigo, erysipelas, cellulit, perianal cellulit)
- invasiv sjukdom såsom sepsis, barnsängsfeber, nekrotiserande fasciit (NF) och streptococcal toxic shock syndrome (STSS).
Halsont är ett vanligt förekommande symtom och flertalet drabbade söker inte vård för det (4). Det är svårt att bestämma incidensen av GAS-faryngit och uppgifterna är mycket osäkra, men äldre studier uppskattar att cirka 15 procent av skolbarn och cirka 4–10 procent av vuxna i höginkomstländer får en GAS-faryngit per år (5).
I tropiska områden är impetigo och andra hudinfektioner betydligt vanligare än i tempererade områden, särskilt vid trångboddhet och dålig tillgång till sjukvård (6, 7). Impetigo orsakas i majoriteten av fallen av Staphylococcus aureus och i andra hand av GAS (8). Även sårinfektioner orsakas främst av S. aureus. Det gäller både akuta och kroniska infektioner, inklusive infekterade operationssår (9). Erysipelas är en ytlig hudinfektion, som ofta orsakas av GAS (3). Den yttrar sig som ett rodnat, ömt och varmt område, ofta lokaliserat till benen. Erysipelas kan också förekomma i ansiktet och på andra hudlokaler.
GAS orsakar också svåra invasiva infektioner (iGAS) med multiorgansvikt, inklusive streptococcal toxic shock syndrome (STSS) (10). Hos barn, till skillnad mot hos vuxna, ser man i 13–20 procent av iGAS-fallen att barnen haft lokal infektion med GAS, till exempel halsinfektion, inom föregående fyraveckorsperiod (11, 12). De vanligaste kliniska syndromen vid invasiv infektion är sepsis utan att någon infektionslokal kan identifieras, nekrotiserande hud- och mjukdelsinfektioner oftast i extremiteter, nedre luftvägsinfektioner och infektioner i anslutning till förlossning (13, 14). Endometrit orsakat av GAS ger vanligen feber och buksmärta med växt av bakterier i blod eller från cervix (15). De flesta fall av postpartuminfektion debuterar inom 48–72 timmar efter förlossning (16).
Patogenesen vid invasiv sjukdom är mycket komplex. Bakterierna behöver penetrera slemhinnor eller hud för att nå djupare vävnad. Den svåra sjukdomsbilden orsakas av dysreglering av koagulation, virulensfaktorer såsom enzymer och andra protein för att undvika immunförsvaret och olika superantigen som orsakar hyperinflammation i kroppen (17).
Spridningsvägar
GAS sprids huvudsakligen via direktkontakt med en smittsam person, antingen via droppsmitta från luftvägarna eller via hudkontakt (17). Smitta genom indirekt kontakt via föremål anses som en möjlig, men inte lika betydelsefull spridningsväg (3, 18).
Bärarskap av GAS är känt och förekommer främst i oropharynx, i skadade hudområden samt genitalt. Bärarskap i halsen hos vuxna inom OECD-länderna var i en metaanalys 2 procent (95 procent konfidensintervall 0,5–5 procent) (19). Hos barn 0–19 år är bärarskap vanligare och i samma studie var andelen barn med bärarskap 10,5 procent (95 procent konfidensintervall 8,4–12,9 procent). Det är osäkert hur länge en individ är bärare.
Smittsamheten hos personer med halsinfektion orsakad av GAS är väl beskriven. Förekomsten av sekundärfall inom samma hushåll och bland nära kontakter var i ett par studier 10–27 procent (20, 21). Hur stor risken är att personer som är bärare av GAS i svalget smittar andra är mindre väl beskrivet. En klassisk experimentell studie från 1962 utförd i en djurmodell (apor) kunde visa att GAS-stammar isolerade från personer med akut infektion smittade aporna i betydligt högre grad än stammar isolerade från bärarskap i svalg (22). Det har rapporterats att GAS vid bärarskap går in i ett viloläge (persistant dormant state) och tillväxer mycket långsamt (23). Bärare av streptokocker i svalget bedöms sammantaget inte sprida GAS till nära kontakter i lika hög utsträckning som symtomatiska fall (21, 24, 25). Det finns undantag, där en liten andel av barn med GAS-bärarskap verkar kunna sprida bakterier via hosta och händer till andra i skolmiljö (26).
Studier på barn och ungdomar visar att antibiotikabehandling vid faryngotonsillit minskar smittsamheten snabbt, efter 24 timmar går det hos majoriteten inte att påvisa levande bakterier i svalget (27, 28).
Eftersom impetigo och andra hudinfektioner dominerar bland GAS-infektioner i tropiska områden, medan faryngotonsillit dominerar i tempererade områden och höginkomstländer bedöms infektionstypernas respektive betydelse för spridning av GAS variera på samma sätt (3, 7). I en studie om impetigo och bärarskap av GAS i svalg i en befolkning med mycket GAS-infektioner bedöms smittan främst spridas från hals till hud (snarare än tvärtom), med slutsatsen att enbart kontroll av hudinfektioner inte är tillräckligt för att hindra smittspridning (29).
Studier har visat att svalgisolat och isolat från invasiva infektioner ofta är lika fylogenetiskt (30, 31). Även en studie på barn där forskare har identifierat bärare av GAS i svalget och utifrån helgenomsekvensering jämfört dessa bakterieisolat med isolat från invasiv sjukdom närliggande i tid, visar att bakterierna kan vara lika genetiskt (32). GAS-isolat från impetigo utgörs ofta av andra emm-typer än dem som är de vanligaste bland isolat från halsinfektion och invasiv sjukdom (33, 34).
Värdfaktorer, bakteriens genotyp samt förekomst av co-infektion med virus anses alla vara viktiga för att iGAS ska utvecklas (35).
De flesta fall av iGAS är sporadiska, i undantagsfall syns kluster av fall. I utbrottsbeskrivningar finns rapporterat relaterade fall av iGAS där fallens insjukningsdatum skiljer sig med flera månader (36, 37). Samma stammar av GAS kan orsaka både lindrig infektion och svårt livshotande infektion (3, 38). Smittspårning runt fall av samhällsförvärvad iGAS bedöms därmed endast förebygga en liten andel av fallen, och nya sporadiska fall som saknar koppling till kända iGAS-fall kommer kunna uppstå.
Riskfaktorer och riskgrupper
Flera faktorer är associerade med ökad risk för iGAS (3, 39, 40). I en äldre fallkontrollstudie identifierades riskfaktorer för iGAS hos personer över 18 år där samsjuklighet i form av hiv, diabetes och cancersjukdom noterades öka risken, liksom kontakt med barn med halsont, och hushållstorlek på tre personer eller fler (39).
Personer med kronisk hjärt-, njur- eller lungsjukdom, immunnedsättning, obesitas och sår- eller hudsjukdomar löper också en ökad risk. Andra grupper med ökad risk är gravida, nyförlösta kvinnor, personer med skadligt bruk av alkohol eller narkotika, hemlösa och äldre. Personer med samtidig eller föregående virusinfektion, såsom influensa och vattkoppor, löper också en ökad risk för iGAS. Detta gäller även för barn (41, 42).
Diagnostik
Diagnostik av GAS vid misstänkt invasiv infektion görs vanligtvis genom blododling och odling av provmaterial från aktuellt infektionsfokus. Falldefinition för anmälningspliktig iGAS i Sverige finns i nedanstående avsnitt om Övervakning av iGAS i Sverige.
GAS växer väl på vanliga odlingsmedier och ger betahemolys på blodagar. Artbestämning till S. pyogenes görs vanligtvis genom kolonimorfologi och betahemolys tillsammans med Matrix-Assisted Laser Desorption/Ionization Time-of-Flight (MALDI-TOF) eller latex-agglutination (Lancefield grupp A).
Nukleinsyrapåvisning av S. pyogenes kan användas för diagnostik, med riktad PCR eller som del i multiplex-PCR-paneler avsedda för diagnostik vid meningit eller luftvägsinfektioner. DNA från GAS kan också påvisas med sekvensering av 16S rRNA-genen. Det sistnämnda är framför allt relevant vid negativ odling eller efter antibiotikabehandling eftersom metoden även kan påvisa döda bakterier.
Vid faryngotonsillit är förstahandsmetoden för diagnostik av GAS påvisning av antigenförekomst med patientnära snabbtest (Strep A). Testet har hög känslighet och specificitet för påvisning av GAS i svalgsekret vid faryngotonsillit (43). Det finns även andra patientnära tester, till exempel PCR/NAAT-metoder, som kan användas för detektion av GAS i svalget, men eftersom de patientnära snabbtesten för påvisning av GAS-antigen är både känsliga, specifika och billiga har dessa metoder inte någon plats i diagnostiken för närvarande (44).
Varken odling eller snabbtester kan skilja mellan bärarskap och infektion. Om syftet med en provtagning är att påvisa bärarskap, rekommenderas vanligtvis odling, till exempel i samband med smittspårning kring iGAS hos en nyförlöst kvinna. Odling och isolering av bakterier medför möjlighet till antibiotikaresistensbestämning och att jämföra isolat med epidemiologisk typning och genetisk släktskapsundersökning om det finns behov vid en smittspårning.
Epidemiologisk typning
Historiskt har GAS karaktäriserats genom serologisk typning, genom att rikta antisera mot antigen på bakteriens yta. De vanligaste typningsmetoderna var T-typning, M-typning och påvisning av serum opacity factor (SOF). Den traditionella serologiska M-typningen ersattes sedan av sekvensbaserad bestämning av emm-genen som kodar för den hypervariabla delen av M-proteinet, så kallad emm-typning. Den serologiska bestämningen kunde särskilja ett 80-tal olika M-typer. I dagsläget finns fler än 250 olika emm-typer beskrivna och utöver det fler än 1900 olika emm-subtyper (45).
Vid utbrottssituationer och smittspårningsutredningar ger enbart emm-typning ofta inte tillräckligt hög upplösning för att avgöra om bakterieisolat är genetiskt relaterade till varandra eller inte. Helgenomsekvensering, med efterföljande genpåvisning, in silico emm-typning, sekvenstypning (ST) och jämförelse av bakteriegenom har ersatt äldre jämförande metoder. De laboratorier som typar GAS i Sverige gör detta numera utifrån helgenomsekvensering.
Epidemiologi
Infektioner med GAS som exempelvis scharlakansfeber var vanliga under 1800-talet och tidiga 1900-talet. Scharlakansfeber var då en betydande orsak till sjuklighet och dödlighet bland barn. Därefter minskade antalet infektioner med GAS. Bättre levnadsstandard och hygien, minskad fattigdom, och utveckling av antibiotika är faktorer som tros ha bidragit till minskningen (46).
Sedan slutet av 1980-talet har återkommande perioder med högre incidens av iGAS-infektioner rapporterats från flera delar av världen, inklusive ökad förekomst av de allvarligare manifestationerna nekrotiserande fasciit och STSS (10, 47). Epidemiologiska studier har visat att det framför allt är typen emm1 som har dominerat under dessa ökningar, och att det är förändrade virulensfaktorer hos denna typ som har medfört ökad virulens (48, 49). Ökad förekomst och utbrott av scharlakansfeber rapporterades 2011 från Kina och andra asiatiska länder (50, 51). Storbritannien såg också en plötslig kraftig ökning av scharlakansfeber under 2014 som följdes av ökningar av iGAS efterföljande år (52).
Hur iGAS-fall definieras och övervakas varierar mellan olika länder, vilket innebär att rapporterad incidens ofta inte är helt jämförbar mellan länder. Däremot kan tendenser och variationer jämföras över tid. Bland länder som övervakar iGAS ses en trend mot ökande antal fall under 2000-talet med en kraftig nedgång av fall 2019–2021, sannolikt relaterat till restriktionerna under pandemin med covid-19 (53, 54). Efter pandemin rapporterade USA och flera europeiska länder en kraftig ökning av iGAS och andra GAS manifestationer, särskilt bland barn i slutet av år 2022 (54-58).
Möjliga orsaker till ökningen av iGAS 2022–2023 kan vara minskad immunitet hos befolkningen till följd av minskad spridning av GAS under pandemin och samtidig ökning av luftvägsvirus och varicella (41, 59). Ändrade egenskaper hos cirkulerande kloner av GAS kan också ha bidragit till ökningen (38, 55, 60, 61).
Under efterföljande säsong 2023–2024 återgick antalet fall av iGAS i en del länder till liknande som innan pandemin, medan andra länder hade fortsatt höga eller högre nivåer. Efter 2024 har antalet fall i flertalet länder återgått till nivåer liknande dem som sågs innan pandemin. I de länder som följt den post-pandemiska ökningen med typning av isolat från invasiva infektioner med GAS sågs framför allt en dominans av emm1-isolat, men även andra typer noterades. I Danmark och Storbritannien noterades till exempel även en betydande andel av emm12 (55). I Nederländerna och Storbritannien ersattes emm1 till stor del hastigt av en tidigare ovanlig subtyp emm3.93 redan under hösten 2023 (62).
Övervakning av iGAS i Sverige
Invasiv infektion med GAS (iGAS) är anmälningspliktigt sedan 2004 enligt smittskyddslagen och smittskyddsförordningen (2004:168 respektive 2004:255) och ska anmälas av behandlande läkare och laboratorium både till smittskyddsläkaren i regionen och till Folkhälsomyndigheten. Falldefinitionen har genomgått mindre förändringar och förtydliganden över tid. Det här är den senaste versionen av falldefinitionen:
Den nationella övervakningen av iGAS görs av Folkhälsomyndigheten, framför allt genom bevakning av fallanmälningar i Sminet men även via kontakter med smittskyddsenheter och vårdhygienenheter samt regelbunden omvärldsbevakning. Hänsyn tas också till signaler från och kontakter med andra länder. Antibiotikaresistens hos GAS följs genom Svebar med årssammanställningar av resistensläget i Swedres-Svarm (63). Via Svebar kan även förekomsten av GAS i olika odlingsmaterial övervakas.
Från anmälningarna i Sminet hämtas information om patientens ålder, kön, klinisk manifestation, provtyp, smittskyddsregion, emm-typ och sekvenstyp om isolat från fallet har typats. Andra fält och fritextfält i anmälan kan innehålla information till exempel om typ av klinisk manifestation eller sjukdomshistorik. Dessa fält är svåra att använda i övervakningen och att framställa statistik från eftersom de inte fylls i konsekvent. Alla fall har inte någon klinisk anmälan. För en del fall, ofta barnsängsfeber, kan laboratorieanmälan saknas. Korrekt ifylld information i anmälningarna möjliggör valida dataanalyser.
Mikrobiell övervakning med typning av isolat
Mellan 2002 och 2004 analyserades isolat från invasiva infektioner med GAS i en studie där även en europeisk jämförelse genomfördes. I Sverige samlades isolat från icke-invasiva hals- och hudinfektioner in parallellt för jämförelse (64-66). Nationellt var emm89, 81, 28, 1 och 12 de vanligaste typerna både bland GAS-infektioner och iGAS. Inga specifika skillnader kunde påvisas mellan isolat från invasiva och ej invasiva infektioner, men vissa subgrupper var mer vanligt förekommande bland invasiv sjukdom (64). Den europeiska jämförelsen visade att emm1 var vanligast, men förekomsten varierade mellan 7 och 33 procent av de typade isolaten i de tio medverkande länderna. I Danmark och Finland var emm28 vanligare än emm1 och i Sverige var emm28, 89 och 81 mer vanligt förekommande (66). Efter att iGAS blev anmälningspliktig 2004 har insamling av isolat genomförts periodvis eller vid påtaglig ökning av fall. Sedan 2022 är insamling av isolat från invasiva infektioner med GAS pausad inom de nationella mikrobiella övervakningsprogrammen. Valet av smittämnen och deras omfattning inom de mikrobiella övervakningsprogrammen prioriteras utifrån Folkhälsomyndighetens bedömning av relevansen av mikrobiella övervakningsdata och möjligheten att genom preventiva insatser påverka situationen.
Den ökade förekomsten av iGAS hos barn 2022 medförde att Folkhälsomyndigheten gjorde en riktad insamling av isolat från barn med iGAS. Under insatsen samlades isolat in från barn i åldersgruppen 0–9 år andra halvåret 2022 samt ett följeisolat övrig ålder för varje barnisolat. Typerna emm1 och emm4 var vanligast och jämförelser av de sekvenserade isolaten påvisade inte någon större klonal spridning. Resultat från typningarna finns publicerat på Folkhälsomyndighetens webbplats (54).
De laborativa metoder som använts på Folkhälsomyndigheten för karaktärisering av GAS-isolat har ändrats över tid. Sedan 2022 utförs helgenomsekvensering rutinmässigt. Utöver typningar som utförts på Folkhälsomyndigheten har Region Skåne typat majoriteten av sina isolat från invasiva infektioner med GAS i egen regi under en längre tid. Sedan halvårsskiftet 2024 helgenomsekvenserar även Karolinska universitetssjukhuset sådana isolat och båda laboratorierna anmäler typningsresultat för isolaten till Sminet. Sedan årsskiftet 2025 är Klinisk mikrobiologi och vårdhygien, Region Skåne nationellt referenslaboratorium för epidemiologisk typning av streptokocker.
Resistensutveckling
Resistens mot penicillin har inte rapporterats för GAS. I samband med covid 19 pandemin noterades en ökad resistens mot erytromycin och klindamycin i flera länder, däribland Sverige. Efter pandemin återgick resistensen till liknande nivåer som innan pandemin (63, 67, 68). USA har under en längre tid haft en ökande erytromycin- och klindamycinresistens och 2023 var 27 respektive 26 procent av de testade isolaten resistenta (69). En förklaring till den ökande resistensen kan vara olika cirkulerande kloner som förvärvat egenskaper för resistensmekanismer. I en begränsad nationell insamling begärde Folkhälsomyndigheten in klindamycinresistenta isolat från invasiva infektioner med GAS identifierade mellan 2019 och 2022. Framför allt emm11 och emm77 påvisades hos de få sparade isolaten (ej publicerade data).
Svensk iGAS-epidemiologi
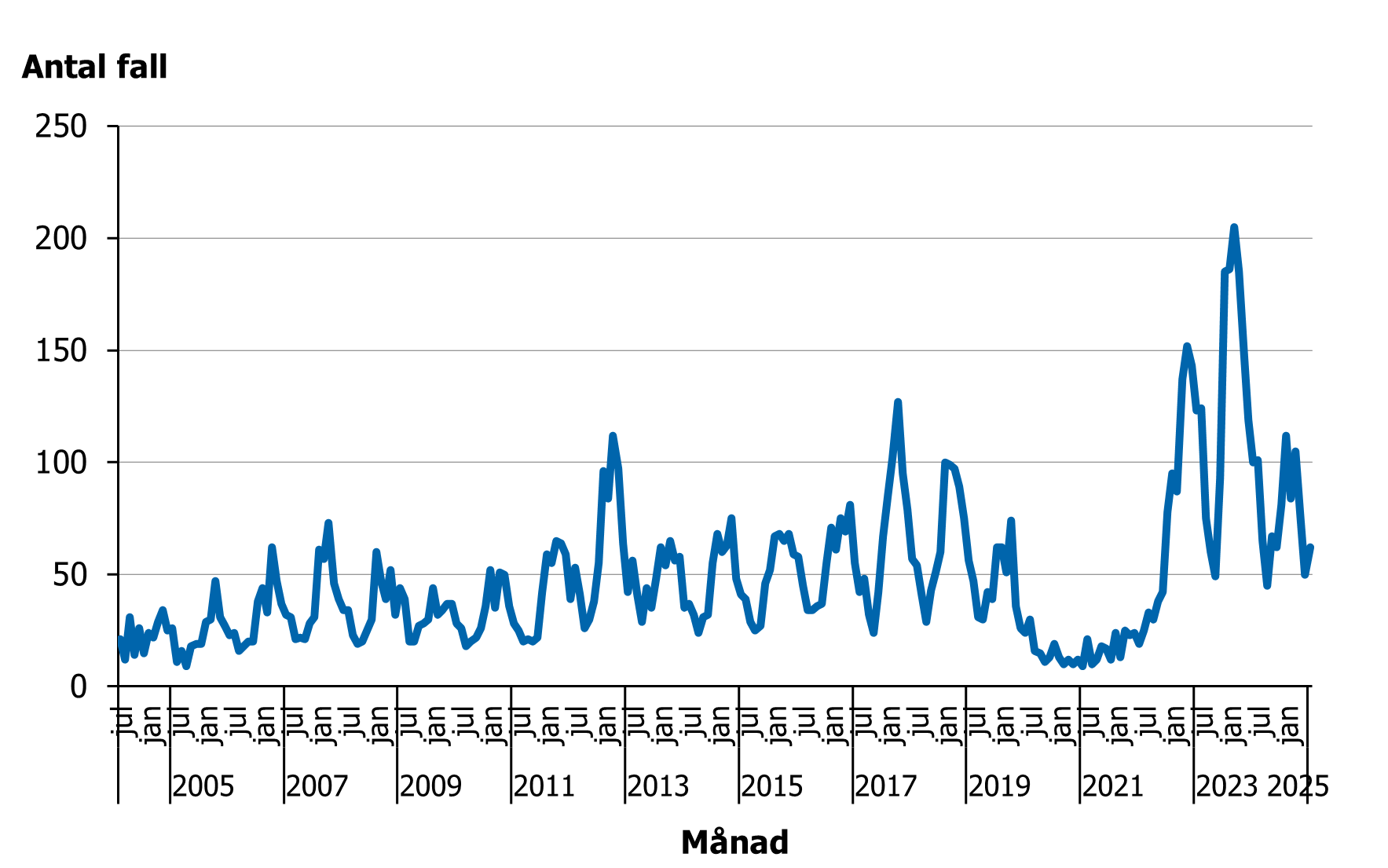
Sedan iGAS blev anmälningspliktigt 2004 har trenden varit långsamt ökande med återkommande perioder av ökat antal fall vart 4–6 år (figur 2). Liknande periodicitet har även beskrivits för antal fall av scharlakansfeber i Storbritannien (70).
Figur 2. Antal fall per månad av iGAS i Sverige, säsongen 2004–2005 till 2024–2025.
En trendanalys visar en signifikant ökning av incidensen sedan 2005 (p=0,006; figur 3). Observera att incidensen av iGAS har påverkats av pandemin under åren 2020 till 2024.
Figur 3. Incidens av iGAS (fall per 100 000 invånare) under åren 2005–2024 samt trend (negativ binomial regressionsmodell).
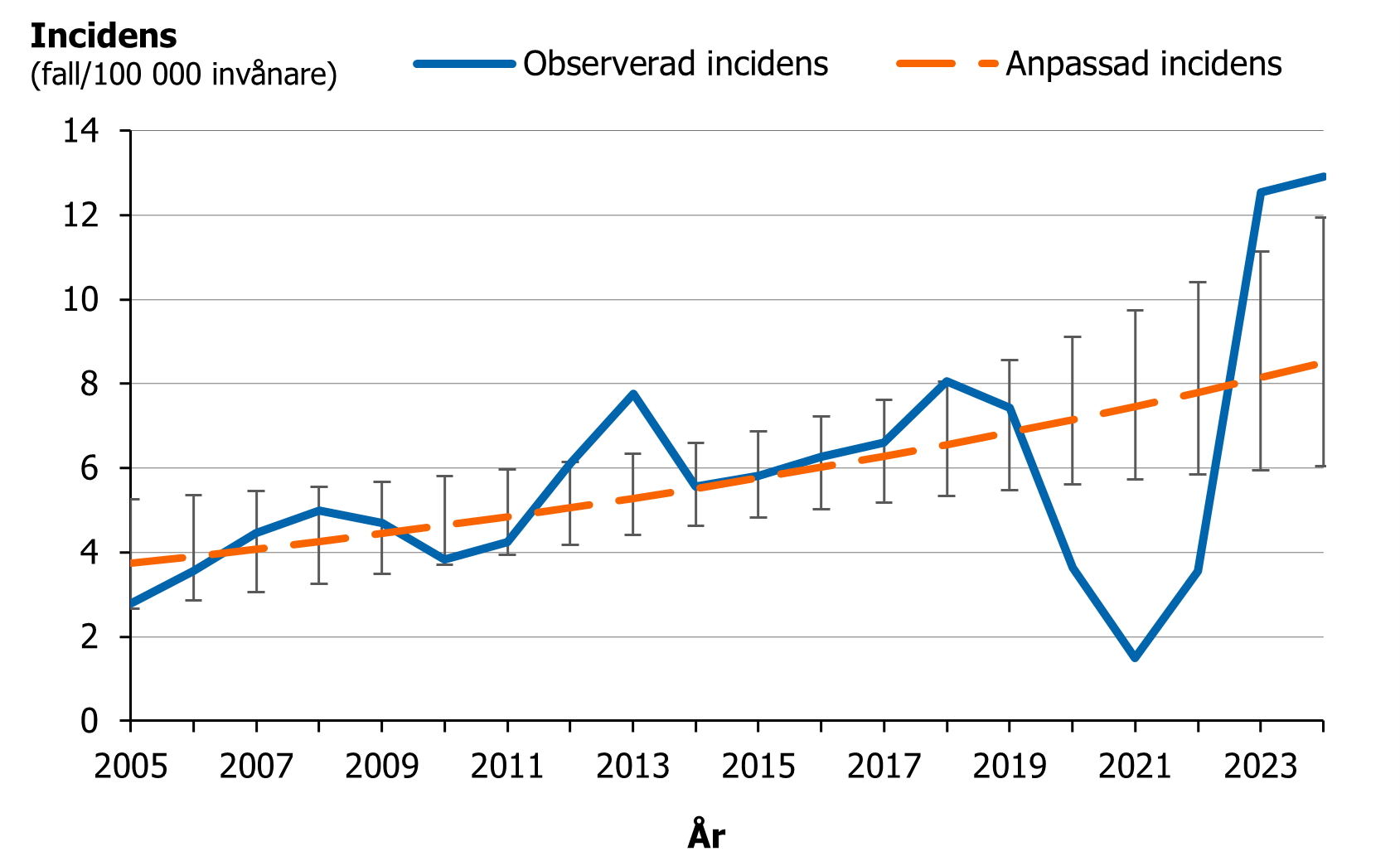
Likt flera andra länder sågs en markant nedgång av fall i Sverige under covid-19-pandemin och en ökning av fall efter att pandemirestriktionerna togs bort. Ökningen som inleddes i slutet av 2022 följdes av en säsong med ytterligare högre incidens. Incidensen under de två säsongerna 2022–2023 (juli till juni) och 2023–2024 var 9,4 (983 fall) respektive 14,6 (1532 fall) fall per 100 000 invånare. Under säsongen 2024–2025 (incidens 8,6 fall per 100 000 invånare, 913 fall) har incidensen i stort återgått till nivåer som noterades åren närmast före pandemin.
Samvariation med andra sjukdomar
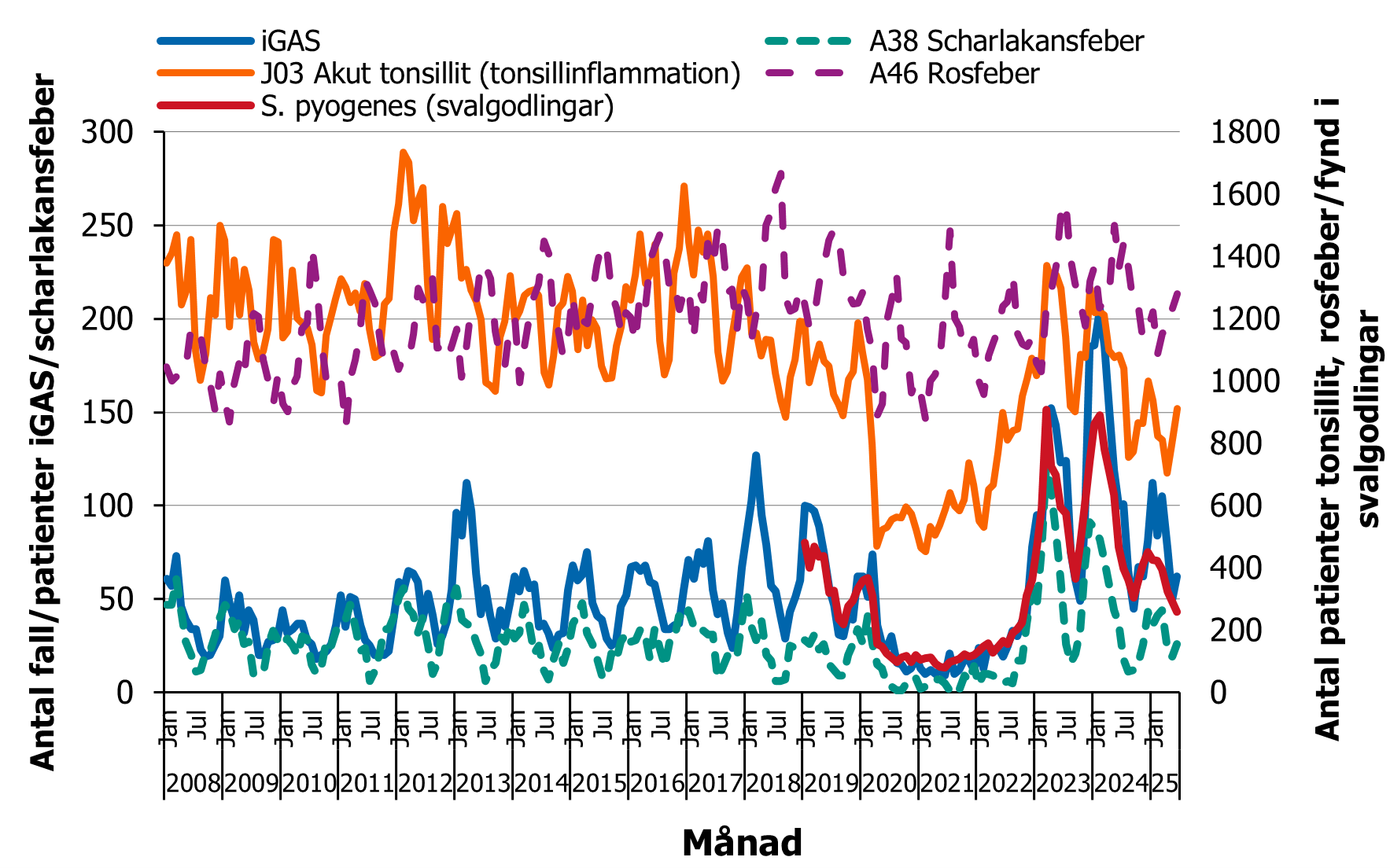
För lindrigare infektioner med GAS finns ingen lagstiftad sjukdomsövervakning. Svebardata för fynd av S. pyogenes (GAS) i svalgodling har tillsammans med patientdata på scharlakansfeber, akut tonsillit och rosfeber (erysipelas) i slutenvård och specialiserad öppenvård från Diagnosregistret (Socialstyrelsen) använts för att försöka följa förekomsten av GAS. Från detta register har data också hämtats för influensa och vattkoppor.
En tydlig samvariation ses för antalet patienter med scharlakansfeber, svalgodlingar med GAS och fall av iGAS (figur 4). Kurvan för patienter med akut tonsillit följer ett liknande mönster, medan rosfeber har ett annat mönster med fler fall under sommarmånaderna och inte samma tydliga ned- och uppgång i antal fall till följd av pandemin. Noterbart är att tonsillit och rosfeber även orsakas av andra smittämnen än GAS, och den senare diagnosen kan blandas ihop med andra hudsjukdomar som ger liknande symtom.
Figur 4. Antalet fall av iGAS per månad (2008-juni 2025), antalet svalgodlingar med fynd av S. pyogenes (2019-juli 2025), antalet patienter med diagnosen scharlakansfeber (A38), akut tonsillit (J03) och rosfeber (A46) i sluten- och/eller specialiserad öppenvård per månad, 2008 till juni 2025.
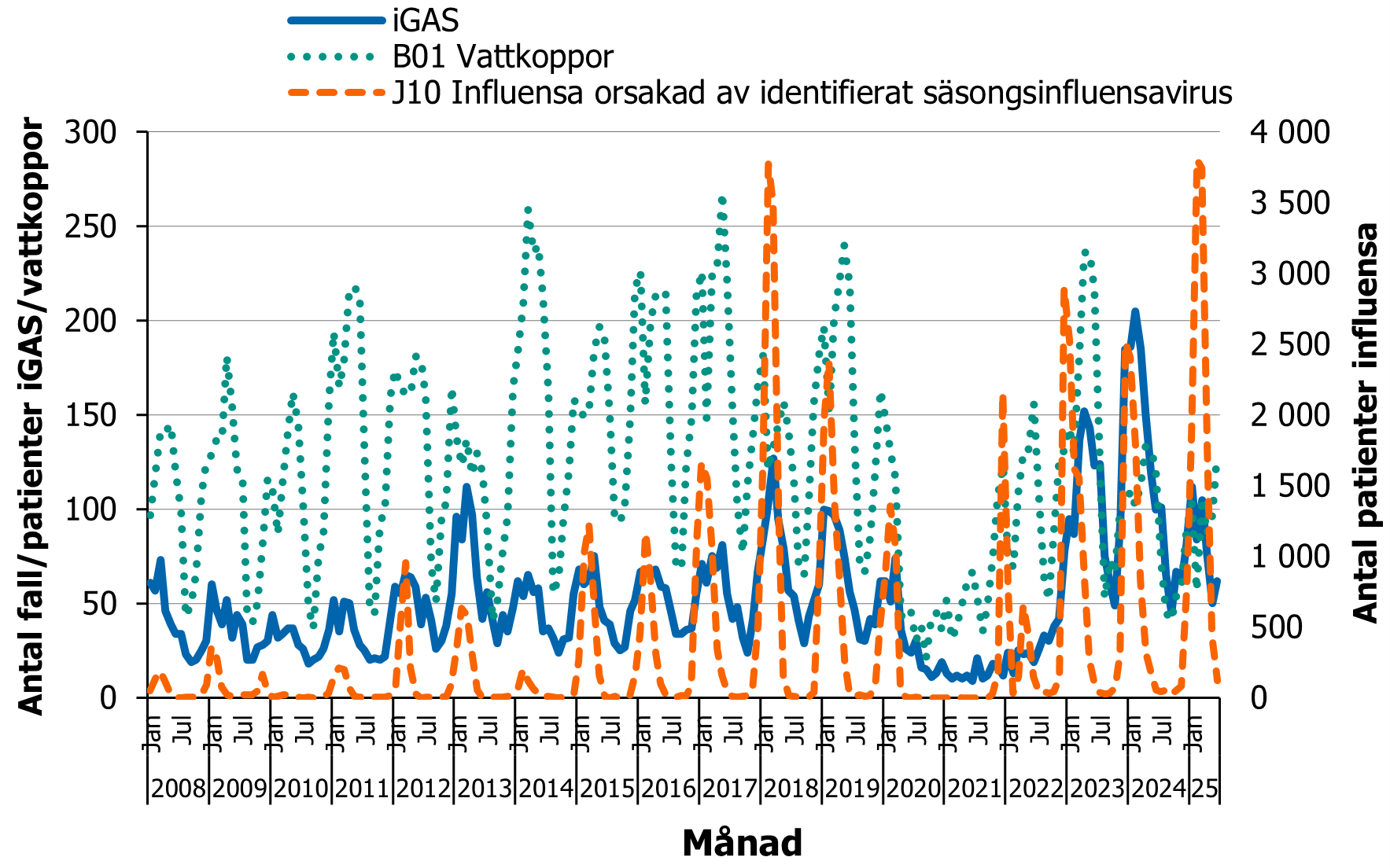
Föregående infektion eller co-infektioner med influensa och vattkoppor är riskfaktorer för infektioner med iGAS (41, 71-73). Båda sjukdomarna har en tydlig säsongsvariation (figur 5) och påverkades av pandemin på liknande sätt som GAS-infektioner (74).
Figur 5. Antalet fall av iGAS per månad, antalet patienter med diagnosen vattkoppor (B01) och influensa (J10) i sluten- och/eller specialiserad öppenvård per månad, 2008 till juni 2025.
Fördjupad analys av epidemiologin säsongerna 2015–2025
För att utvärdera nationella iGAS-data närmare användes falldata från Sminet perioden juli 2015 till juni 2025. Bakgrundsdata samt fördjupad information om uppgiftskällor, datahantering och definitioner finns i bilaga 2.
För att få en förståelse för vilka faktorer som kan påverka risken att få iGAS i Sverige (co-infektioner, boende på SÄBO, hemtjänst, barn i samma hushåll) samt mortaliteten i olika grupper gjordes samkörningar mellan Sminetdata och registerdata inhämtade för analys av covid-19 (bilaga 2). Detta är en förstudie för eventuell vidare undersökning av riskfaktorer för iGAS och ökad dödlighet.
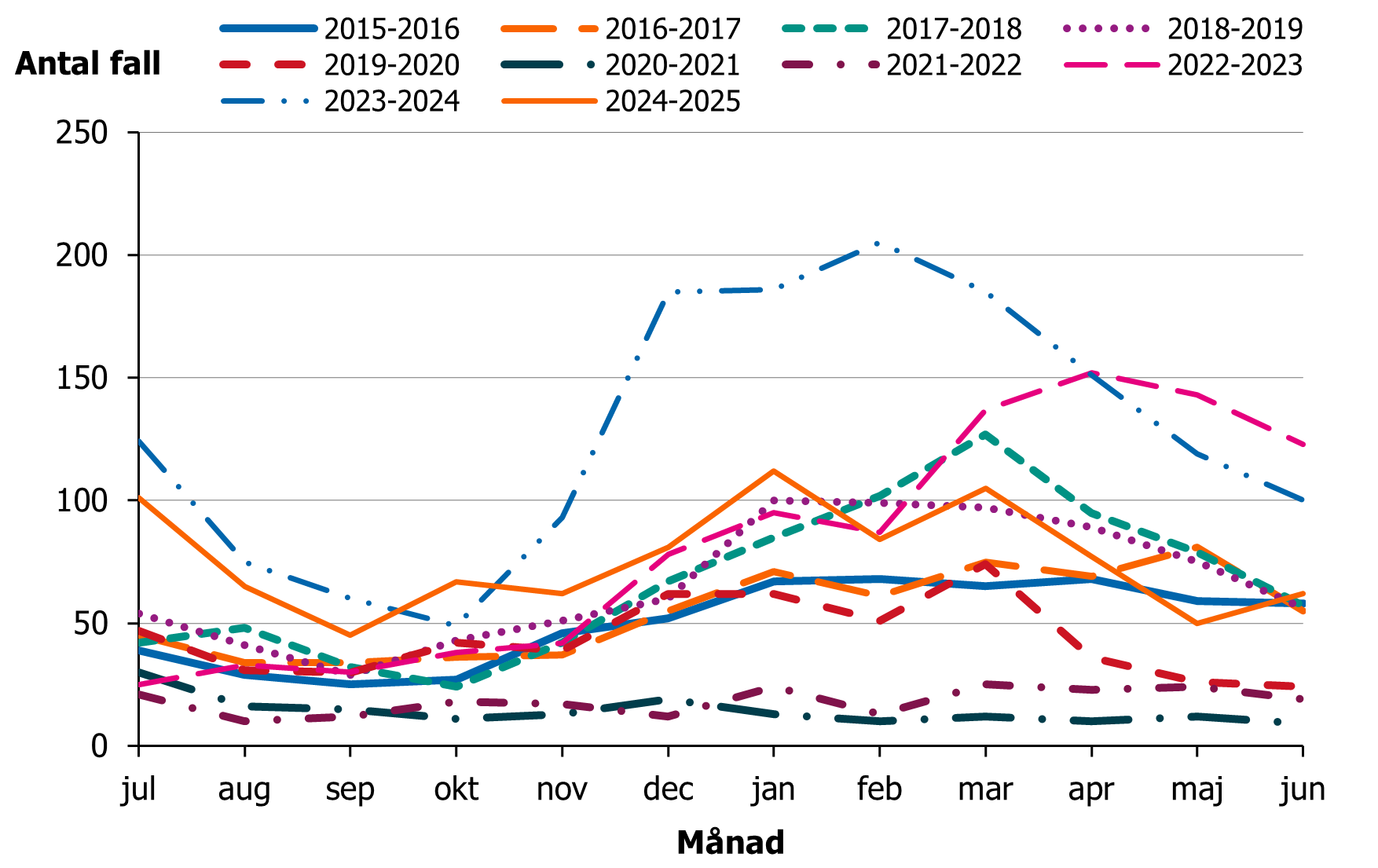
Säsongsvariation, köns- och åldersfördelning
I Sverige har rapporterade fall av iGAS en tydlig säsongsvariation med flest fall under vårvintern (figur 6). Under perioden juli 2015 till juni 2025 rapporterades totalt 7188 fall, varav 51 procent kvinnor (3630 fall) och 49 procent män (3557 fall). Medianålder för fallen under perioden var 62 år; 59 år för kvinnor och 64 år för män. En något högre medianålder sågs före pandemin än efter pandemin, 66 år respektive 59 år.
Figur 6. Antal fall av iGAS per månad, säsongerna (juli–juni) 2015–2016 till 2024–2025.
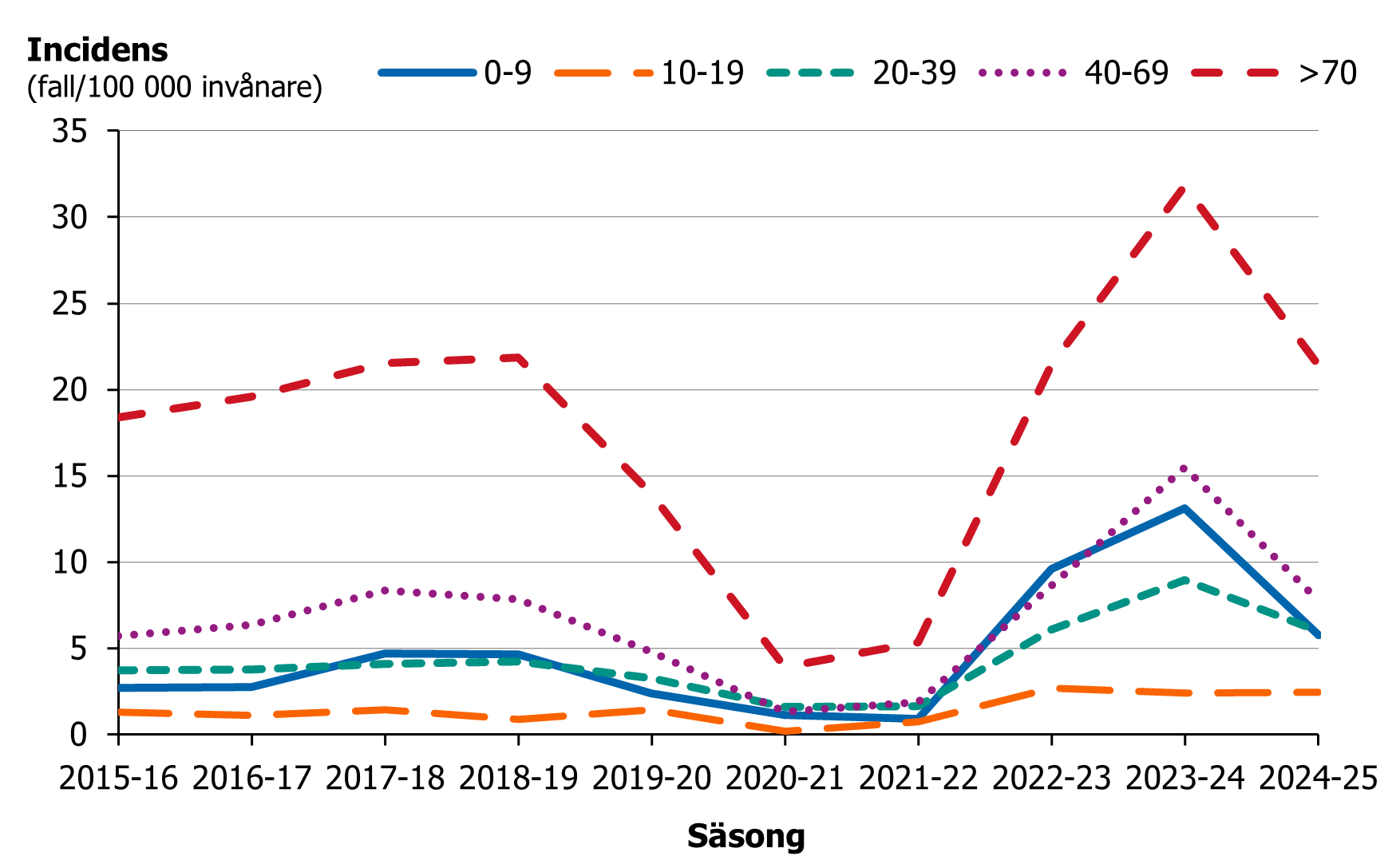
Incidensen var högst i åldersgruppen 70 år och äldre under hela perioden (figur 6). En högre andel kvinnor noterades i åldersgruppen 20–39 år (71 procent) jämfört med män i samma åldersgrupp (29 procent). Efter pandemin ökade incidensen bland barn 0–9 år, från 2,7 till 4,7 fall per 100 000 invånare de fyra säsongerna innan pandemin till 9,6 och 13,1 de båda säsongerna efter pandemin (figur 7). Säsongen 2023–2024 noterades även en högre andel fall i åldersgruppen 40–69 år (38 procent). Tidigare säsonger har åldersgruppen 70 år och äldre dominerat.
Figur 7. Incidensen av iGAS per åldersgrupp, säsongerna (juli–juni) 2015–2016 till 2024–2025.
Fördelning av kliniska manifestationer, mortalitet och provtyp
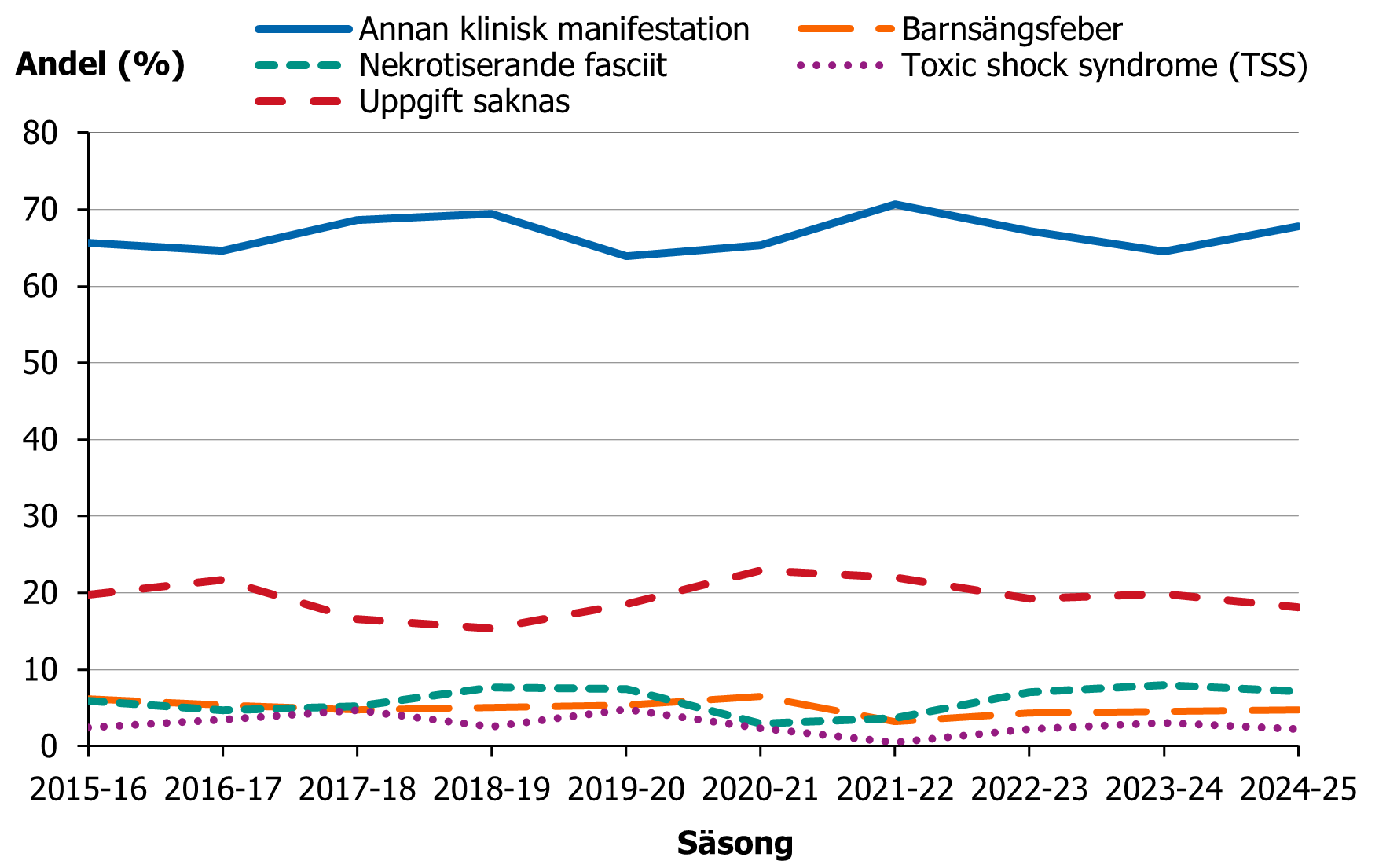
Kliniska anmälningar fanns för 5851 fall (81 procent) under perioden 2015–2025. Enligt dessa anmälningar rapporterades 478 fall med NF (7 procent), 351 fall med barnsängsfeber (5 procent), 215 fall av STSS (3 procent). För 4785 fall (67 procent) angavs annan klinisk manifestation, vilket innebär att patienten, enligt rapporterande läkare, inte hade någon av de kliniska manifestationer (barnsängsfeber, NF och STSS) som finns specificerade i det kliniska anmälningsformuläret. Ingen större variation sågs i fördelningen av de kliniska manifestationerna mellan säsongerna (figur 8).
Figur 8. Andelen kliniska manifestationer av iGAS, säsongerna (juli–juni) 2015–2016 till 2024–2025.
Fördelningen av iGAS-fallen på kön och åldersgrupp visar att 72 procent av fallen i åldersgruppen 20–39 år utgjordes av kvinnor, vilket förklaras av barnsängsfeber. Mer än hälften av alla fall med NF var i åldersgruppen 40–69 år (n=262, 55 procent). Även fall med STSS var vanligast i denna åldersgrupp (n=90, 42 procent). Ingen större skillnad i förekomst av NF och STSS sågs mellan könen.
Under perioden avled elva procent av fallen (n=782) inom 30 dagar efter diagnos- eller statistikdatum. Andelen avlidna har varierat mellan 10 och 15 procent över säsongerna. Medianåldern för dödsfallen var 81 år, med en spridning på 79–86 år. Mortaliteten för fallen med STSS och NF var 33 respektive 13 procent.
Enligt falldata hade 80 procent GAS i blodet, 3 procent i ledvätska, 3 procent i vävnad och 2 procent i pleuravätska. För fallen med barnsängsfeber saknade 35 procent uppgift om provmaterial. Efter covid-19-pandemin noterades fler fall med fynd av GAS i pleuravätska, framförallt bland barn 0–9 år (54). Säsongen 2023–2024 rapporterades 11 fall av GAS i cerebrospinalvätska, att jämföra med 1–2 rapporterade fall övriga säsonger.
Geografisk fördelning
Under perioden 2015–2025 varierade incidensen mellan 1 och 22 fall per 100 000 invånare i landets regioner. Den högsta incidensen rapporterades från regionerna Västerbotten, Västernorrland och Gotland säsongen 2023–2024 (incidens 22, 20 respektive 20 fall per 100 000 invånare). Den geografiska incidensen har setts variera både inom och mellan regionerna, orsakerna till variationen är inte utredd (54).
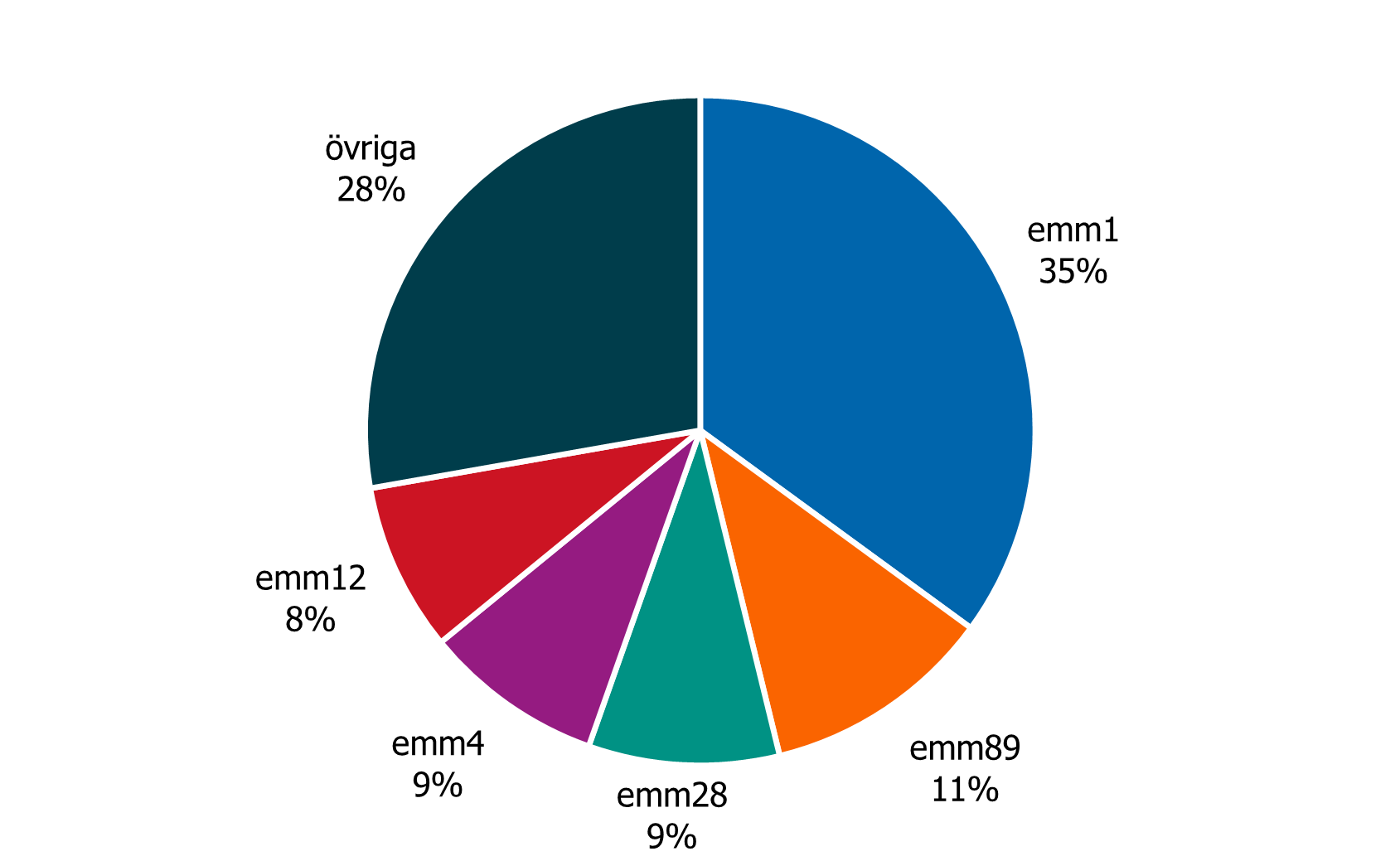
Emm-typer
Emm-typ finns rapporterad för 32 procent av fallen och andelen typade har varierat mellan 15 procent säsongen 2023–2024 och 51 procent säsongen 2017–2018. De vanligaste typerna redovisas i figur 9. Emm1 har dominerat under större delen av perioden förutom säsongerna under pandemin (2020–2021 och 2021–2022) och den senaste säsongen 2024–2025 då emm4 var vanligast bland de typade isolaten. Emm1 och emm12 var de dominerande typerna säsongen 2022–2023 (54). Emm1 och emm12 var också vanligast i flera andra länder i samband med uppgången efter pandemin (38, 55). Detta är data som bör tolkas med försiktighet eftersom en relativt liten andel av isolaten har typats de senaste säsongerna.
Figur 9. Fördelning av emm-typer baserat på 2323 isolat från 32 procent av fallen säsongerna 2015–2016 till 2024–2025.
Co-infektioner
Analysen av co-infektioner, där rapporterade fall av influensa och covid-19 i Sminet användes, visade att som mest hade 4 procent av iGAS-fallen en rapporterad co-infektion med antingen covid-19 (säsongerna 2022–2024) eller influensa (säsongerna 2022–2025). En co-infektion definierades som fall där statistikdatum för influensa eller covid-19 inföll inom två veckor före, eller två veckor, efter iGAS-fallets statistikdatum.
Uppenbara brister i analysen är att andra relevanta co-infektioner som till exempel övriga luftvägsvirus och varicella (vilka också kan föregå iGAS-infektioner) inte kunde undersökas utifrån de befintliga registren. De flesta som insjuknar i covid-19 eller influensa provtas inte, vilket medför att de inte heller rapporteras i Sminet.
iGAS-fall bland boende på SÄBO eller med hemtjänst
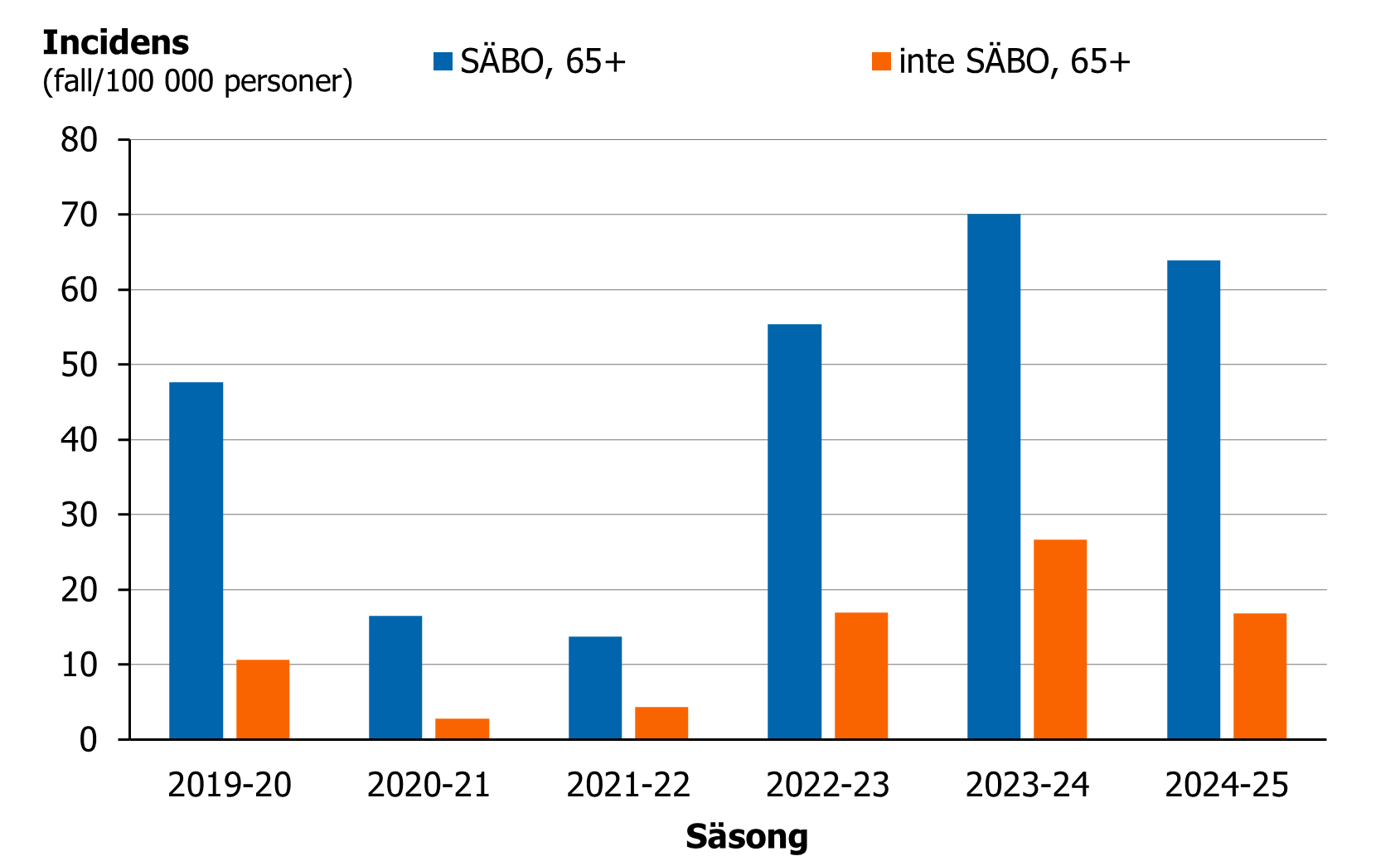
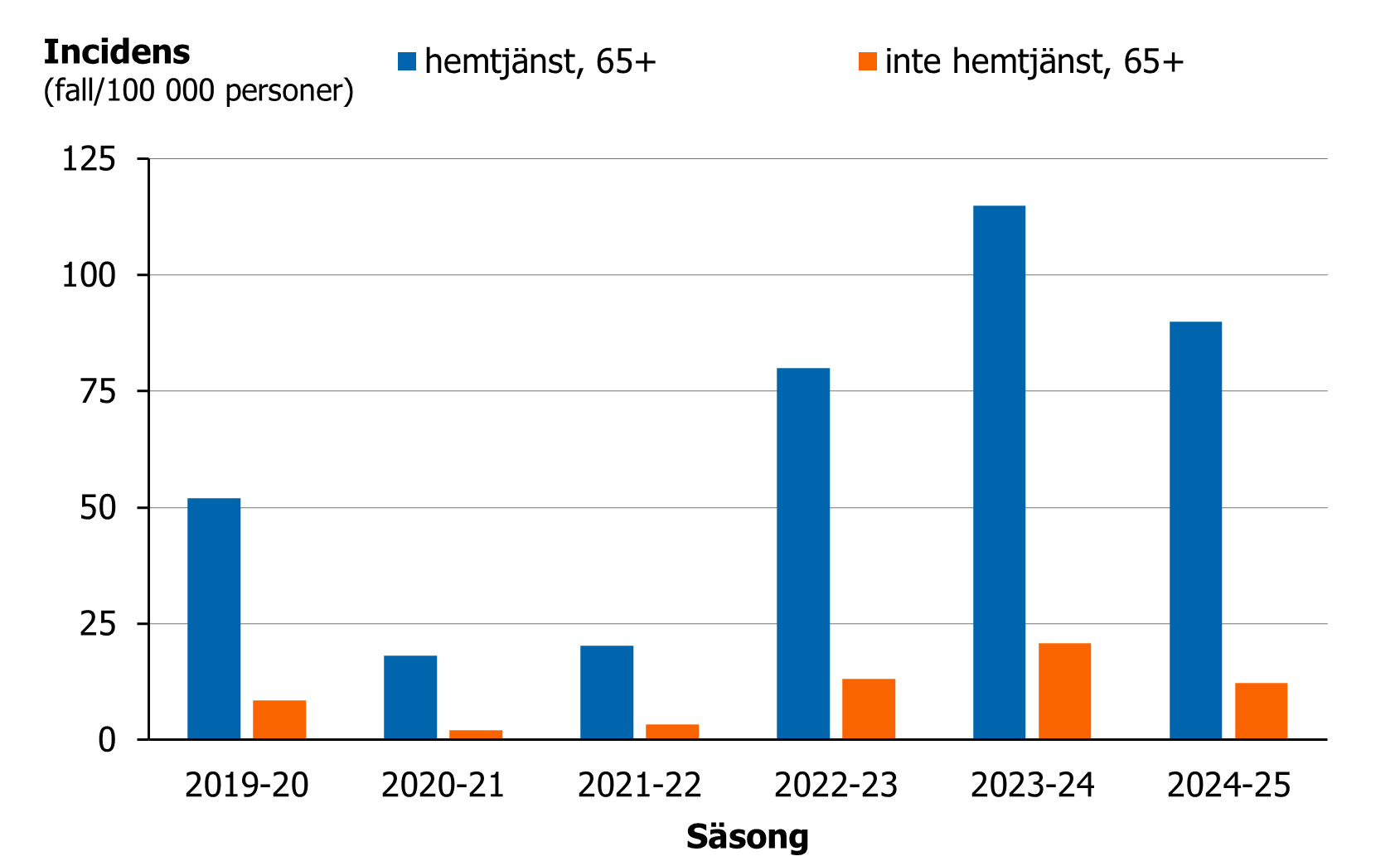
En högre incidens av iGAS noterades för personer 65 år och äldre som bodde på SÄBO eller hade hemtjänst jämfört med personer 65 år och äldre som inte bodde på SÄBO (figur 10) eller hade hemtjänst (figur 11). Grupperna på SÄBO och med hemtjänst samvarierar med stigande ålder. De som bor på SÄBO kan antas vara skörare än de med hemtjänst.
Figur 10. För personer över 65 år visas antal iGAS-fall per 100 000 boende på SÄBO samt antal iGAS-fall per 100 000 inte boende på SÄBO, säsongerna (juli–juni) 2019–2020 till 2024–2025.
Figur 11. För personer över 65 år visas antal iGAS-fall per 100 000 personer med hemtjänst samt antal iGAS-fall per 100 000 personer som inte har hemtjänst, säsongerna (juli–juni) 2019–2020 till 2024–2025.
iGAS-fall med barn i samma hushåll
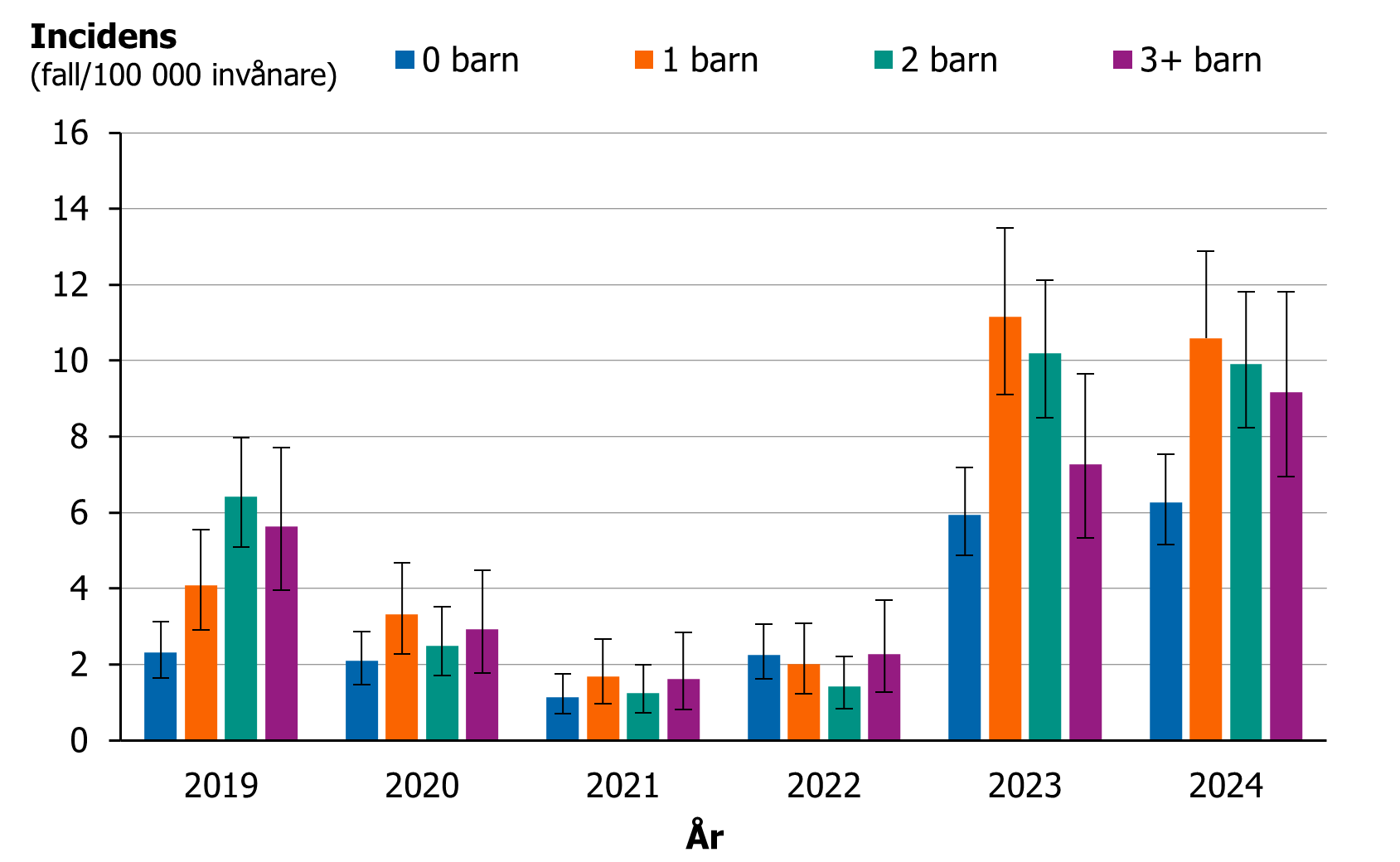
För att undersöka incidensen av iGAS-fallen hos vuxna mellan 18 och 50 år som bodde i hushåll med barn användes data från SCB. Bland den vuxna befolkningen i reproduktiv ålder (definierat här som 18–50 år) beräknades incidensen beroende på antalet barn i hushållet (figur 12). Under pandemiåren (2020–2022) noterades ingen skillnad i incidens beroende på antalet barn i hushållet. Under åren 2019, 2023 och 2024 var incidensen lägre bland vuxna utan barn i hushållet jämfört med vuxna som bodde med barn. Särskilt 2019 var incidensen högre bland vuxna i åldern 18–50 år med 2 eller 3+ barn jämfört med vuxna i samma ålder som inte bodde med barn. Åren 2023 och 2024 var incidensen högre bland vuxna i åldern 18–50 år som bodde med 1 eller 2 barn jämfört med dem som bodde utan barn.
Figur 12. Incidens av iGAS (fall per 100 000 invånare) uppdelad på antal hemmaboende barn, åldersgruppen 18–50 år, 2019–2024.
Mortalitet i olika grupper
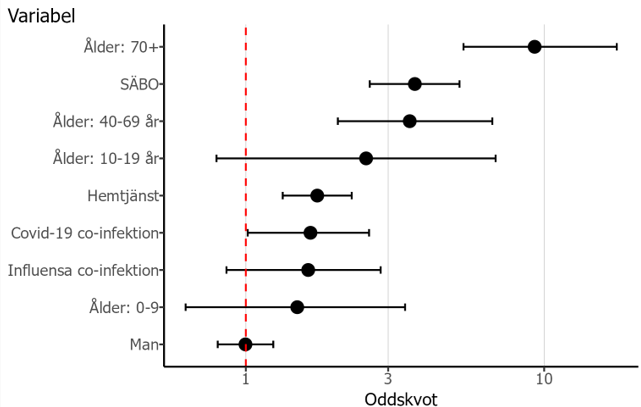
För att analysera faktorer som var förknippade med ökad dödlighet gjordes en multivariabel logistisk regressionsmodell, med data för fall från och med februari 2020. Modellen beräknade oddskvot för död inom 30 dagar jämfört med en referensgrupp efter justering för ålder, kön, boende på SÄBO, hemtjänst samt co-infektioner med covid-19 respektive influensa (figur 13, tabell 1 i bilaga 2). Resultaten visade att högre ålder (över 40 år), boende på SÄBO, hemtjänst samt covid-19 co-infektion var associerade med ökad dödlighet.
Figur 13. Multivariabel logistisk regressionsmodell, utförd på populationen av iGAS-fall från februari 2020 och framåt, där utfallet är död inom 30 dagar från iGAS-datumet. Oddskvoter som är större än 1 och har konfidensintervall (KI) som inte sträcker sig över 1 innebär att det, efter justering för de andra variablerna i modellen, finns en högre odds för död jämfört med referensgruppen.
Sammanfattning och slutsatser för svensk iGAS-epidemiologi
- Över tid har iGAS i Sverige ökat långsamt.
- Antalet fall av iGAS per 100 000 invånare var högst i åldersgruppen 70 år och äldre under säsongerna 2015–2025.
- Medianålder för fallen under säsongerna 2015–2025 var 62 år och fallen var jämnt fördelade mellan kvinnor och män.
- En högre andel kvinnor noterades i åldersgruppen 20–39 år jämfört med män i samma åldersgrupp, 72 respektive 28 procent, vilket förklaras av barnsängsfeber.
- Ingen större variation noterades för andelen av olika kliniska manifestationer eller för 30 dagars mortalitet mellan säsongerna.
- Den vanligaste typen av iGAS under säsongerna 2015–2025 var emm1, men andelen isolat som typats är relativt liten, särskilt under de senaste säsongerna.
- Högre ålder är en riskfaktor för iGAS och för död. Medianålder för dödsfallen var 81 år och andelen avlidna varierade mellan 10 och 15 procent över säsongerna.
- Under pandemin minskade antalet fall av iGAS drastiskt.
- Efter pandemin ökade antalet fall kraftigt, jämfört med nivåerna innan pandemin.
- Initialt noterades ökningen av fall framför allt bland barn 0–9 år.
- Bidragande orsaker till ökningen av fall efter pandemin kan vara minskad immunitet mot GAS i befolkningen, samtida ökningar av andra infektionssjukdomar som till exempel influensa, RSV och vattkoppor, men också förändrad förekomst och virulens hos cirkulerande stammar.
- En återgång till nivåer likt dem innan pandemin noterades säsongen 2024–2025.
I Sverige ses en ökande trend av fall med iGAS sedan anmälningsplikten infördes 2004. Möjliga orsaker till ökningen kan vara bättre diagnostik och att svenska befolkningen blir allt äldre (75). Äldre personer är en heterogen grupp där även andra riskfaktorer än hög ålder är vanliga, till exempel kronisk hjärt- eller lungsjukdom, sämre immunsvar och sår- eller hudsjukdomar.
Spridningsmönster i särskilda miljöer
Ansamlingar av iGAS-fall är ovanliga men förekommer, ofta inom miljöer med många sårbara individer som till exempel äldrevård, förlossningsvård samt förskola och skola. I rapporter om iGAS-utbrott beskrivs vanligen att flera fall av lindriga GAS-infektioner upptäckts vid smittspårning. Spridningar inom dessa miljöer förekommer även i Sverige, men sammanställs inte systematiskt.
Boende på SÄBO, hemtjänst och hemsjukvård
Inom olika omvårdnadsformer kan GAS spridas av de boende, besökare och personal (36, 37). Vanliga orsaker till smittspridning är brister i hygienrutiner som handhygien och såromvårdnad (37). Riktlinjer och checklistor för att hantera utbrott inom äldrevård finns beskrivna internationellt (76, 77).
Utbrott på SÄBO eller inom hemtjänst i Sverige förekommer och hanteras vid behov av den regionala vårdhygien- eller smittskyddsenheten. Under 2016 inträffade en spridning av GAS på ett SÄBO där fyra boende avled till följd av allvarliga infektioner med GAS (78). Under 2025 identifierades en spridning av GAS på ett seniorboende, med tre iGAS-fall som följd (ej publicerade data).
Operationsavdelning
Utbrott av GAS-infektion och iGAS på operationsavdelningar har rapporterats, men är ovanliga (79-82). Förutom spridning via patienter och vårdpersonal, kan spridning förekomma via föremål och damm. I Sverige stängdes en operationsavdelning ner tillfälligt år 2012 efter att sex patienter smittats av GAS i samband med kirurgi. Av dessa hade fyra en mycket aggressiv infektion, varav tre behövde intensivvård (83).
Förlossning och nyföddhetsvård
Flera utbrott av GAS-infektion och iGAS inom mödravård och förlossningsverksamhet finns beskrivna (84-86). Många regioner i Sverige har egna vårdhygieniska riktlinjer för att hantera fall vid fynd av GAS hos en nyförlöst kvinna eller ett nyfött barn (87). Under 2018 identifierades och rapporterades smittspridning på en förlossningsavdelning i Sverige med totalt fem fall av barnsängsfeber. Analysen visade att smittspridning sannolikt skett från personalen till patienter i fyra av de fem fallen (86). Under 2025 identifierades smittspridning vid en förlossningsavdelning med fyra fall av barnsängsfeber. Smittspårning gjordes och i personalen identifierades flera bärare av GAS. Utifrån helgenomsekvensering av GAS-isolaten kunde ursprunget för smittspridningen identifieras och behandlas (ej publicerade data).
Förskola och skola
Flera beskrivningar av utbrott av GAS-infektion inom förskola och skola finns rapporterade (26, 88, 89). I Sverige finns beskrivet ett utbrott av GAS-infektion och iGAS på en förskola år 2012 med totalt tio fall. Tidigt identifierades två ECMO-behandlade patienter med iGAS som var vårdnadshavare med barn på förskolan, och vid vidare utredning gjordes fynd av GAS i svalgodlingar hos sju barn och en anhörig till personal på förskolan. Nio isolat från fallen typades och alla var av typen emm1 (88).
Via livsmedel och infekterad kökspersonal
Livsmedelsburna utbrott av GAS är mycket ovanliga, och har orsakats av smittbärare som hanterat ätfärdiga livsmedel (90-92). Det senaste dokumenterade utbrottet i Sverige inträffade 2003. Totalt 153 personer insjuknade vid fem olika tillfällen i halsfluss orsakad av GAS (93). Smittkällan var smörgåstårta från en och samma leverantör, och samma stam påvisades i sår på tillverkarens finger, halsen på patienter och i överbliven tårta.
Hemlösa och personer med skadligt bruk av alkohol eller narkotika
Hemlösa och personer med skadligt bruk av alkohol eller narkotika är grupper i befolkningen som är sårbara för en mängd olika virala och bakteriella infektioner. Flera utbrott av GAS bland dessa grupper har rapporterats (40, 94). Vid en retrospektiv undersökning av iGAS med typ emm66, 2013–2015, identifierades 18 patienter i Sverige med skadligt bruk av alkohol eller narkotika varav tio var hemlösa (Folkhälsomyndigheten; ej publicerade data).
Hushåll
I studier av hushåll där barn med halsinfektion orsakad av GAS identifierades var nära 25 procent av hushållskontakterna koloniserade med GAS (25). Fler barn i hushållet förknippades med ökad risk för spridning av faryngit (20). Hushåll med flera personer är förknippat med ökad risk för smittspridning av GAS-infektion och iGAS. Vid ett fall av iGAS ökar den relativa risken 1940 gånger över bakgrundsincidensen för ytterligare ett fall av iGAS i hushållet (95). En ökad risk för iGAS har också noterats för hushållskontakter till fall med scharlakansfeber, även om den absoluta risken är låg (96).
Karakteristika hos GAS-infektioner som är viktiga ur smittskyddssynpunkt
- I tempererade områden och höginkomstländer har GAS-infektioner en säsongsvariation med topp under vårvintern. Infektionerna har beskrivits främst utgöras av faryngotonsillit och scharlakansfeber. Förekomsten av iGAS samvarierar med dessa infektionstyper. Hud- och mjukdelsinfektioner orsakade av GAS beskrivs inte i dessa publikationer (3, 7, 97).
- I tropiska områden beskrivs också epidemier av GAS-infektioner. Här är hud- och mjukdelsinfektioner vanligare och förekommer tillsammans med faryngotonsillit och scharlakansfeber. Typerna av förekommande GAS-stammar är mer varierande i dessa områden (3, 7).
- Avgränsade utbrott och smittspridningar av lindriga GAS-infektioner och iGAS har rapporterats förekomma i olika miljöer, som sjukhusvård (ofta inom obstetrik och kirurgi), äldrevård, förskole- och skolverksamhet. I dessa miljöer har olika typer av GAS-infektioner, liksom bärarskap av GAS identifierats. När det gäller åtgärder har information och utbildning, smittspårning, genomgång av hygienrutiner och antibiotikaprofylax till riskgrupper beskrivits (36, 76, 77, 84, 89, 98, 99).
- Samma typer av GAS kan orsaka både lindriga infektioner och iGAS.
- GAS sprids huvudsakligen från smittade personer via droppsmitta eller genom direktkontakt. Spridning via indirekt kontakt kan förekomma, men bedöms vara av mindre betydelse. Spridning inom hushåll och till nära kontakter från personer med halsinfektion orsakad av GAS är vanlig.
- Individer med symtomatisk halsinfektion med GAS bedöms vara mer smittsamma än bärare.
- Hur stor betydelse bärare har för smittspridningen i befolkningen är oklart.
Genomgång av möjliga förebyggande åtgärder mot iGAS
De åtgärder som diskuteras nedan ska inte ses som rekommendationer. Denna genomgång och diskussion förs med avsikten att utgöra grund för fortsatt nationellt arbete, där olika kunskapsstöd kan tas fram till prioriterade verksamheter och allmänheten i samarbetsprojekt.
Här beskrivs möjliga åtgärder som bedömts kunna ha en effekt för att förebygga iGAS. Avsikten är att ha med alla tänkbara åtgärder. Därför listas även sådana som är helt eller delvis implementerade. Evidensen och det allmänna kunskapsläget i fråga om effekter mot iGAS för åtgärderna bedöms översiktligt, liksom mer allmän kunskap och erfarenhet som har betydelse för aktuella åtgärder. Ingen bedömning görs av negativa effekter, resursåtgång eller genomförbarhet för de åtgärder som diskuteras. För att kunna ta fram detaljerade kunskapsstöd, till exempel vägledning, rekommendationer och information, behöver dessa aspekter diskuteras och analyseras mer grundligt och i förhållande till de verksamhetsområden som berörs.
Den översiktliga litteraturgenomgången visar att evidensläget är svagt för samtliga beskrivna åtgärder för att minska smittspridning i samhället. En viktig förklaring till detta är sannolikt att det är svårt att utforma och genomföra studier som tydligt visar på en effekt för enskilda åtgärder mot smittspridning.
En kort beskrivning av verksamhetsområden görs för att kort ge underlag för prioritering av områden. Några exempel på möjlig tillämpning av åtgärder ges också inom respektive verksamhetsområde. I fortsatt arbete kommer de olika åtgärderna behöva konkretiseras ytterligare och bedömas utifrån respektive verksamhetsområde och situation.
Möjliga åtgärder
Numreringen av åtgärderna nedan är endast avsedd att underlätta hänvisning och innebär inte någon prioritering.
Organisatoriska åtgärder (nr 1–3) på myndighetsnivå för information, samordning och övervakning
1. Använd optimala informationskanaler för att sprida smittskyddsinformation till olika målgrupper
Beskrivning: Ta fram exempelvis smittskyddsblad, information till myndigheters webbplatser, behandlings- och handläggningsrekommendationer, rådgivningsstöd och bedömningskriterier vid telefonrådgivning, patientinformation som kan ges vid läkarbesök och sjukdoms- och symtomrelaterade råd som exempelvis ges på 1177, samt information till och via verksamhetschefer i samband med utbrott.
Evidens och kunskapsläge: Utbrottsbeskrivningar och rekommendationer från ett flertal verksamhetsområden, exempelvis äldrevård, förskola och skola, betonar vikten av att informera och utbilda verksamhetsansvariga i relevanta smittskyddsåtgärder (36, 76, 98-101).
I övrigt har den litteratursökning som gjorts för denna översikt inte visat några studier som specifikt ger stöd för att denna åtgärd minskar förekomsten av iGAS.
Exempel på möjlig tillämpning: Den viktigaste tillämpningen är att systematiskt använda sig av denna typ av informationskanaler för att kommunicera viktig smittskyddsinformation. Att se till att informationen är synkroniserad och konsekvent har också stor betydelse.
2. Utarbeta samarbetsrutiner med de aktörer som ansvarar för viktiga informationskanaler för smittskyddsinformation
Beskrivning: Det här gäller för de informationskanaler som beskrivs i åtgärd 1. Fastställ och använd optimala informationskanaler för att sprida smittskyddsinformation till olika målgrupper. Inblandade aktörer behöver ta fram och komma överens om samarbetsrutiner, dels för långsiktig regelbunden uppdatering av informationen i aktuella kanaler, dels för att snabbt kunna diskutera, ta fram, förankra och disseminera tillägg eller ändringar i gällande information om det finns behov av det ur smittskyddssynpunkt.
Evidens och kunskapsläge: Vikten av korrekt och samstämmig information brukar ofta betonas i utbrottsbeskrivningar (36, 76, 98-101).
I övrigt har den litteratursökning som gjorts för denna översikt inte visat några studier som specifikt ger stöd för att denna åtgärd minskar förekomsten av iGAS.
Exempel på möjlig tillämpning: Informera om ökad smittspridning, när det är lämpligt att söka vård och tecken på allvarlig infektion, anpassa och förmedla denna information både till allmänheten och vården.
3. Utvärdera och överväg att förändra epidemiologisk och mikrobiell övervakning av iGAS, beakta även värdet av data för andra infektioner orsakade av GAS
Beskrivning: Publicering av täta och regelbundna sammanställningar av antal anmälda fall ger alla aktörer möjlighet att följa förekomsten och att aktivera eventuella åtgärder. Rutinmässig sekvensering av isolat från invasiva infektioner med GAS inom utvalda områden skulle ge bättre möjlighet att upptäcka smittspridningar, till exempel inom äldreomsorg, hemtjänst eller kvinnosjukvård, men även inom andra verksamheter, under förutsättning att det kombineras med epidemiologisk information om fallen. Smittspårning och uppföljning av iGAS-fall och sammanställning av inhämtade data skulle ge bättre kartläggning av fallen och eventuella epidemiologiska samband.
Evidens och kunskapsläge: Övervakning i sig påverkar inte iGAS-förekomsten. Däremot är övervakningen en nödvändig grund för att kunna bedöma vilka åtgärder som kan vara relevanta och rimliga. Utökad övervakning kan också öka kunskap om spridningsmönster.
Värdet av en rutinmässig mikrobiell övervakning begränsas av den stora samhällsspridningen som innebär att identiska isolat och kluster av isolat från invasiva infektioner med GAS ofta kan identifieras, men där fallen saknar känd epidemiologisk koppling. Sekvensering är dock användbart i situationer där det finns flera fall av iGAS med epidemiologisk koppling, inte minst inom vårdinrättningar. Där kan helgenomsekvensering bidra till att utesluta smitta mellan fallen om det visar sig att isolaten är olika.
Åtgärder (nr 4–8) kring sjukdomsfall som syftar till att minska smittspridning
4. Minimera kontakt mellan infekterade och friska
Beskrivning: Ge råd om att stanna hemma vid sjukdom och om att riskgrupper inte ska utsättas för smitta. Råden kan ges som allmän utbildning till olika målgrupper (vissa verksamheter, vårdnadshavare med flera) eller som riktad information till infekterade personer eller riskgrupper.
Evidens och kunskapsläge: Åtgärden är en allmänt vedertagen smittskyddsåtgärd. Att människor stannade hemma vid sjukdom minskade smittspridningen av flera luftvägsinfektioner under pandemin med covid-19.
I övrigt har den litteratursökning som gjorts för denna översikt inte visat några studier som specifikt ger stöd för att denna åtgärd minskar förekomsten av iGAS.
Exempel på möjlig tillämpning: Att ge råd om att barn med halsont eller andra övre luftvägsinfektioner inte ska träffa äldre familjemedlemmar eller andra riskgrupper kan diskuteras som åtgärd. För pneumokocker har man sett en ökad förekomst av invasiv sjukdom i samband med ledigheter som jul och nyår. En hypotes är att smittspridning sker när barn och äldre släktingar umgås nära, till exempel i samband med storhelger (102).
Betona vikten av att vårdpersonal med sår på händer inte ska arbeta nära vård- och omsorgstagare.
5. Bryt smittvägar
Beskrivning: När det gäller att motverka spridning av GAS bedöms handhygien, host- och nysetikett, vissa andra hygienråd (att inte dela handduk, mat och dryck med mera) och skyddsutrustning (inom vård och omsorg) kunna vara av värde.
Evidens och kunskapsläge: Enligt allmänt vedertagen kunskap är dessa åtgärder effektiva för att bryta kontakt- och droppsmitta. De har beskrivits som viktiga för att hantera utbrott i olika verksamheter (76, 100, 103).
I övrigt har den litteratursökning som gjorts för denna översikt inte visat några studier som specifikt ger stöd för att denna åtgärd minskar förekomsten av iGAS.
Exempel på möjlig tillämpning: Generell utbildning av målgrupper, till exempel personal på SÄBO, förskola och inom sjukvård. Information till patienter i samband med besök i sjukvården.
6. Smittspårning och uppföljning av iGAS-fall
Beskrivning: Att smittspåra och följa upp iGAS-fall är en förutsättning för att kunna tillämpa vissa smittförebyggande åtgärder i anknytning till inträffade fall. Det är också nödvändigt för att kunna identifiera eventuella utbrott inom olika verksamheter. Uppföljning och informationsinsamling kring fall bidrar till kunskapsuppbyggnad.
Evidens och kunskapsläge: Smittspårning och uppföljning av fall är vedertagen praxis i Sverige för de sjukdomar där man vill identifiera utbrott, öka kunskapen om fallen och sjukdomen, och tillämpa smittskyddsåtgärder inom ett eller flera verksamhetsområden. Uppföljning för att identifiera fall i verksamheter där smittspridning har inträffat har beskrivits i rapporter och finns i rekommendationer om utbrott i exempelvis äldreomsorg, sjukhus och skolor (36, 76, 84, 98-101).
I övrigt har den litteratursökning som gjorts för denna översikt inte visat några studier som specifikt ger stöd för att denna åtgärd minskar förekomsten av iGAS.
Exempel på möjlig tillämpning: Att vid ett fall av iGAS ta reda på om patienten eller hens familj arbetar, bor eller deltar i en verksamhet där risken för smittspridning av GAS är hög, och om det finns fler personer med ökad risk för iGAS. Exempel på sådana verksamheter är förskola och skola, äldreomsorg, förlossning och nyföddhetsvård. Om det är så kan verksamheten exempelvis informeras om det aktuella fallet och vara uppmärksam på nya fall. Det leder också till förbättrad rapportering och ökad kunskap om utbrott i sårbara miljöer.
7. Antibiotikaprofylax till riskgrupper runt iGAS-fall
Beskrivning: Åtgärden innebär att exponerade individer som tillhör riskgrupp och där någon i deras närhet insjuknat i iGAS ges profylaktisk behandling med antibiotika.
Evidens och kunskapsläge: Storbritannien tillämpar antibiotikaprofylax till riskgrupper runt iGAS-fall (77) efter att epidemiologiska data tydligt pekade på en ökad risk för äldre över 75 år, nyförlösta, nyfödda och individer infekterade med vattkoppor. Kopplingen var svagare för samtidig influensainfektion, hemlöshet, eller personer med skadligt bruk av alkohol eller narkotika (104).
I övrigt har den litteratursökning som gjorts för denna översikt inte visat några studier som specifikt ger stöd för att denna åtgärd minskar förekomsten av iGAS.
Exempel på möjlig tillämpning: Riskgrupper kan definieras olika, i Storbritannien som har nationella riktlinjer för detta ingår äldre över 75 år, gravida från vecka 37, nyförlösta kvinnor (<28 dagar) samt nyfödda under 28 dagars ålder (77). Även personer med aktiv vattkoppsinfektion vid exponeringstillfället definieras tillhöra riskgrupp.
Utöver hushållsmedlemmar kan nära kontakter vara personer som exponerats mer än 24 timmar per vecka med indexpatienten veckan innan insjuknandet.
När en nyförlöst mamma, ett spädbarn eller då någon i ett hushåll med en person över 75 år insjuknar i iGAS kan antibiotikaprofylax till modern, barnet eller personer 75 år eller äldre vara en åtgärd som övervägs (95).
8. Anpassning av diagnostik och behandling av misstänkta GAS-infektioner
Beskrivning: Syftet med den här åtgärden är att behandla en större andel av symtomatiska, lindriga GAS-infektioner och därigenom minska smittspridning, samtidigt som balansen mellan nytta och skada både med antibiotikabehandling för den enskilda patienten och antibiotikaresistensförekomst i samhället ska vara avgörande för utformningen av behandlingsrekommendationer.
Avsikten med denna åtgärd är att smittskyddsaspekter behöver beaktas när rekommendationer om diagnostik och behandling tas fram.
Evidens och kunskapsläge: Att behandla smittsamma personer är allmänt accepterat som en effektiv smittskyddsåtgärd.
Det saknas studier som visar att ökad diagnosticering och behandling av lindriga GAS-infektioner minskar smittspridningen, och därmed förekomsten av iGAS.
Exempel på möjligtillämpning: Fortsätt följa kunskapsläget om optimal nivå för diagnostik och behandling av halsinfektioner med GAS. Fortsatt långsiktigt, gemensamt arbete mellan myndigheter och berörda specialistföreningar med evidensbaserade rekommendationer och tydlig kommunikation. Hur eventuella behov av ändrade rekommendationer med anledning av förändringar i epidemiologiskt läge ska hanteras behöver också diskuteras vidare.
Vaccination (nr 9–10)
9. Vaccination mot GAS
Beskrivning: Det finns idag inget vaccin mot GAS. En översiktsartikel beskriver åtta vaccinkandidater, fyra baserade på M-proteinet och fyra baserade på icke-M-proteinantigener (105). Ingen av kandidaterna har kommit längre än till fas 1-studier gällande immunogenicitet och tolerans. Eftersom GAS är en strikt humanpatogen kompliceras vaccinutvecklingen av att djurmodeller ger begränsad information om effekt och säkerhet för människor.
10. Vaccination mot vattkoppor och influensa
Beskrivning: Infektion med vattkoppor och influensa ökar risken för iGAS. Det talar för att vaccination mot dessa även kan förebygga iGAS, utöver att ge skydd mot den infektion som vaccinet avser förebygga.
Evidens och kunskapsläge: Vaccination mot vattkoppor verkar minska risken för vattkoppsassocierad iGAS, däremot är effekten på incidensen av iGAS i stort i barnpopulationen blygsam (106). För influensavaccin finns en studie bland amerikansk militär som visar att förekomsten av GAS-infektion minskar av influensavaccination, det finns däremot inget specifikt om iGAS i studien (107).
Verksamhetsområden för framtida nationellt arbete
Här beskrivs några områden, olika typer av verksamheter respektive hela samhället, som kan bli aktuella för nationella kunskapsstöd, till exempel vägledningar och annan information, för att förebygga iGAS. Exempel på möjliga tillämpningar av åtgärder ges, även sådana åtgärder som är helt eller delvis implementerade. Valet av områden har baserats dels på etablerade riskgrupper (se avsnittet om riskgrupper respektive epidemiologi ovan), dels på beskrivningar av utbrott av och smittspridningar av lindrig GAS-infektion och iGAS (36, 76, 98-101).
Följande områden omfattas:
- Allmänheten, hela samhället. Området behöver finnas med eftersom flera av de diskuterade åtgärderna kommer beröra hela befolkningen.
- Förlossning och nyföddhetsvård. Inom det här området har det sedan länge tillämpats omfattande förebyggande arbete eftersom spridning av GAS och dess allvarliga konsekvenser upptäcktes tidigt.
- Förskola och skola. Här har det också förekommit utbrott av GAS-infektion och i sällsynta fall iGAS, både i Sverige och internationellt.
- Äldrevård och hemsjukvård. Här har utbrott av GAS-infektion och iGAS beskrivits och internationellt finns flera vägledningar för förebyggande arbete.
Allmänheten, hela samhället
Exempel på möjliga tillämpningar: Flera av de åtgärder som diskuteras kommer att beröra allmänheten och hela samhället. Det gäller exempelvis råd om när människor ska söka sjukvård. Rekommendationer för att förebygga smittspridning som integreras i behandlingsriktlinjer påverkar också alla potentiella patienter. När allmän information om hur man undviker smitta ges samlat för flera sjukdomar, kan även infektioner orsakade av GAS beaktas. Rutiner för hur informationskanaler ska samordnas och användas på bästa sätt behöver vidareutvecklas, både gällande normal uppdatering och uppdateringar initierade av förändrade smittlägen.
Att ge antibiotikaprofylax till äldre över 75 år i samma hushåll som iGAS-fall är också en tänkbar åtgärd som kan utvärderas ytterligare.
Förlossning och nyföddhetsvård
Exempel på möjliga tillämpningar: Gravida från vecka 37, nyförlösta (inom 28 dagar) och nyfödda till 28 dagar tillhör riskgrupper för iGAS. Därmed kan antibiotikaprofylax vid exponering för GAS övervägas som en åtgärd för dessa grupper.
Smittspårning och uppföljning av fall inklusive bland personal är en tänkbar åtgärd när misstanke om spridning finns.
Åtgärderna 4. Minimera kontakt mellan infekterade och friska, 5. Bryt smittvägar, och 6. Smittspårning och uppföljning av iGAS-fall är självklara vid smittspridningar och behöver även finnas med i kontinuerliga utbildningsprogram.
Förskola och skola
Exempel på möjliga tillämpningar: Att informera vårdnadshavare och personal om vaksamhet för symtom och spridningsvägar för GAS vid ett fall av iGAS.
Inga generella restriktioner för asymtomatiska kontakter, men genomgång och utbildning gällande hygienrutiner.
Åtgärderna 4. Minimera kontakt mellan infekterade och friska, 5. Bryt smittvägar, och 6. Smittspårning och uppföljning av iGAS-fall är självklara vid smittspridningar och behöver även finnas med i kontinuerliga utbildningsprogram.
SÄBO, hemtjänst och hemsjukvård
Exempel på möjliga tillämpningar: Informera personal och övriga boende om symtom på GAS-infektion och vikten av att snabbt rapportera sjukdomstecken vid ett konstaterat fall av iGAS hos en vårdtagare.
Eftersträva hög vaccinationstäckning mot influensa (åtgärd 9. Vaccination mot vattkoppor och influensa).
Antibiotikaprofylax till exponerade personer som tillhör riskgrupp är en åtgärd som kan övervägas.
Genomgång av hygienrutiner, särskilt när det gäller handhygien och sårvård.
Åtgärderna 4. Minimera kontakt mellan infekterade och friska, 5. Bryt smittvägar, och 6. Smittspårning och uppföljning av iGAS-fall är självklara vid smittspridningar och behöver även finnas med i kontinuerliga utbildningsprogram.
Kunskapsluckor och angelägna kliniska studier
I det här avsnittet beskrivs ett antal tänkbara studier som kan bidra till kunskap i handläggningen av GAS-infektioner och iGAS. Det finns naturligtvis fler kunskapsluckor att studera och det skulle också kunna vara en separat aktivitet att framöver ordna ett seminarium för att brett diskutera angelägna studier.
Antibiotikaprofylax till personer som haft kontakt med iGAS-fall
I ett australiskt projekt planeras en randomiserad klinisk studie av antibiotikaprofylax till hushållskontakter till iGAS-fall. Planen är att randomisera till singeldos azitromycin eller standardprofylax med betalaktamantibiotika (i Australien cefalexin 10 dagar eller singeldos benzathine penicillin intramuskulärt) eller placebo. Primärt utfallsmått är växt av GAS i svalgodling dag 14. I en svensk kontext hade det inneburit att ge penicillin V som profylax.
Modellering av bärarskap och smittvägar
Eftersom GAS enbart är en humanpatogen befinner sig förenklat hela bakteriepopulationen hos människan, antingen på huden, i slemhinnor eller i luftvägarna, som kolonisatör eller patogen.
Modelleringen skulle kunna utgå från bärarskapsfrekvens i olika åldrar, incidens av de olika GAS-orsakade infektionstyperna per åldersgrupp, samt uppgifter om skillnader i smittsamhet mellan symtomfria bärare och infekterade patienter. Sedan uppskatta olika sannolikheter för kontakt mellan smittsam och mottaglig individ. Målet skulle vara att få en uppfattning om hur smitta sker, det vill säga vem som smittar vem och kunna se hur de flesta med iGAS har fått sin infektion.
Utökad diagnostik med PCR för luftvägsvirus och snabbtest för GAS
Planera för en så kallad kluster-randomiserad studie i primärvården där hälften av vårdgivarna ger standardhandläggning av faryngotonsillit som behandlingsriktlinjerna ser ut idag och hälften gör multiplex-PCR för luftvägsvirus samt snabbtest för GAS på alla som söker med halsont. Preliminära utfallsmått skulle kunna vara antal personer med etiologisk diagnos, antibiotikaanvändning, återbesök och smitta inom hushållet. En mer ambitiös studie skulle kunna vara att vid fynd av både luftvägsvirus och GAS vid provtagning så randomiseras patienten till antibiotika eller placebo, för att bestämma om behandling av GAS vid samtidig virusinfektion gör nytta.
Kohortstudie för att undersöka värdfaktorer och nära spridning vid iGAS
Man kan tänka sig en prospektiv kohortstudie med fall av iGAS som utgångspunkt. För fallen görs djup analys av immunologiska värdfaktorer för sjukdom och kartläggning av andra riskfaktorer. Hushållskontakter till fallen provtas och följs för att kartlägga smittvägar och bärarskap, samt uppföljning av kontakter för att identifiera sekundärfall.
Referenser
- Folkhälsomyndigheten. Falldefinitioner vid anmälan enligt smittskyddslagen, 2025. Artikelnummer: 25001. 2025.
- Brouwer S, Rivera-Hernandez T, Curren BF, Harbison-Price N, De Oliveira DMP, Jespersen MG, et al. Pathogenesis, epidemiology and control of Group A Streptococcus infection. Nat Rev Microbiol. 2023;21(7):431-47.
- Efstratiou A, Lamagni T. Epidemiology of Streptococcus pyogenes. In: Ferretti JJ, Stevens DL, Fischetti VA, editors. Streptococcus pyogenes: Basic Biology to Clinical Manifestations. Oklahoma City (OK). 2022.
- Mehta N, Schilder A, Fragaszy E, H ERE, Dukes O, Manikam L, et al. Antibiotic prescribing in patients with self-reported sore throat. J Antimicrob Chemother. 2017;72(3):914-22.
- Carapetis JR, Steer AC, Mulholland EK, Weber M. The global burden of group A streptococcal diseases. Lancet Infect Dis. 2005;5(11):685-94.
- Bowen AC, Mahé A, Hay RJ, Andrews RM, Steer AC, Tong SY, et al. The Global Epidemiology of Impetigo: A Systematic Review of the Population Prevalence of Impetigo and Pyoderma. PLoS One. 2015;10(8):e0136789.
- Bessen DE, Smeesters PR, Beall BW. Molecular Epidemiology, Ecology, and Evolution of Group A Streptococci. Microbiol Spectr. 2018;6(5).
- Darmstadt GL, Lane AT. Impetigo: an overview. Pediatr Dermatol. 1994;11(4):293-303.
- Uberoi A, McCready-Vangi A, Grice EA. The wound microbiota: microbial mechanisms of impaired wound healing and infection. Nat Rev Microbiol. 2024;22(8):507-21.
- Defining the group A streptococcal toxic shock syndrome. Rationale and consensus definition. The Working Group on Severe Streptococcal Infections. Jama. 1993;269(3):390-91.
- Zachariadou L, Stathi A, Tassios PT, Pangalis A, Legakis NJ, Papaparaskevas J. Differences in the epidemiology between paediatric and adult invasive Streptococcus pyogenes infections. Epidemiol Infect. 2014;142(3):512-19.
- Erlacher R, Toepfner N, Dressen S, Berner R, Bösch A, Tenenbaum T, et al. Are Invasive Group A Streptococcal Infections Preventable by Antibiotic Therapy?: A Collaborative Retrospective Study. Pediatr Infect Dis J. 2024;43(10):931-35.
- Gregory CJ, Okaro JO, Reingold A, Chai S, Herlihy R, Petit S, et al. Invasive Group A Streptococcal Infections in 10 US States. Jama. 2025;333(17):1498-507.
- Dabaja-Younis H, Kandel C, Green K, Johnstone J, Zhong Z, Kassee C, et al. Invasive Group A Streptococcal Infection in Children, 1992-2023. JAMA Netw Open. 2025;8(4):e252861.
- Harris K, Proctor LK, Shinar S, Philippopoulos E, Yudin MH, Murphy KE. Outcomes and management of pregnancy and puerperal group A streptococcal infections: A systematic review. Acta Obstet Gynecol Scand. 2023;102(2):138-57.
- 16Hamilton SM, Stevens DL, Bryant AE. Pregnancy-related group a streptococcal infections: temporal relationships between bacterial acquisition, infection onset, clinical findings, and outcome. Clin Infect Dis. 2013;57(6):870-76.
- Walker MJ, Barnett TC, McArthur JD, Cole JN, Gillen CM, Henningham A, et al. Disease manifestations and pathogenic mechanisms of Group A Streptococcus. Clin Microbiol Rev. 2014;27(2):264-301.
- Barth DD, Daw J, Enkel SL, McRae T, Carapetis JR, Wyber R, et al. It's not just droplets: a systematic review and meta-analysis of the modes of transmission of Group A Streptococcus. Front Public Health. 2025;13:1630054.
- Oliver J, Malliya Wadu E, Pierse N, Moreland NJ, Williamson DA, Baker MG. Group A Streptococcus pharyngitis and pharyngeal carriage: A meta-analysis. PLoS Negl Trop Dis. 2018;12(3):e0006335.
- Lindbaek M, Høiby EA, Lermark G, Steinsholt IM, Hjortdahl P. Predictors for spread of clinical group A streptococcal tonsillitis within the household. Scand J Prim Health Care. 2004;22(4):239-43.
- Musher DM. How contagious are common respiratory tract infections? N Engl J Med. 2003;348(13):1256-66.
- Krause RM, Rammelkamp CH, Jr. Studies of the carrier state following infection with group A streptococci. II. Infectivity of streptococci isolated during acute pharyngitis and during the carrier state. J Clin Invest. 1962;41(3):575-8.
- Bessen DE. Population biology of the human restricted pathogen, Streptococcus pyogenes. Infect Genet Evol. 2009;9(4):581-93.
- Shulman ST, Bisno AL, Clegg HW, Gerber MA, Kaplan EL, Lee G, et al. Clinical practice guideline for the diagnosis and management of group A streptococcal pharyngitis: 2012 update by the Infectious Diseases Society of America. Clin Infect Dis. 2012;55(10):e86-102.
- Martin J. Chapter 18, The Carrier State of Streptococcus pyogenes. In: Streptococcus pyogenes: Basic Biology to Clinical Manifestations [Internet]. 2nd edition.2022.
- Cordery R, Purba AK, Begum L, Mills E, Mosavie M, Vieira A, et al. Frequency of transmission, asymptomatic shedding, and airborne spread of Streptococcus pyogenes in schoolchildren exposed to scarlet fever: a prospective, longitudinal, multicohort, molecular epidemiological, contact-tracing study in England, UK. Lancet Microbe. 2022;3(5):e366-e75.
- Snellman LW, Stang HJ, Stang JM, Johnson DR, Kaplan EL. Duration of positive throat cultures for group A streptococci after initiation of antibiotic therapy. Pediatrics. 1993;91(6):1166-70.
- Schwartz RH, Kim D, Martin M, Pichichero ME. A Reappraisal of the Minimum Duration of Antibiotic Treatment Before Approval of Return to School for Children With Streptococcal Pharyngitis. Pediatr Infect Dis J. 2015;34(12):1302-04.
- Lacey JA, Marcato AJ, Chisholm RH, Campbell PT, Zachreson C, Price DJ, et al. Evaluating the role of asymptomatic throat carriage of Streptococcus pyogenes in impetigo transmission in remote Aboriginal communities in Northern Territory, Australia: a retrospective genomic analysis. Lancet Microbe. 2023;4(7):e524-e33.
- Li Y, Dominguez S, Nanduri SA, Rivers J, Mathis S, Li Z, et al. Genomic Characterization of Group A Streptococci Causing Pharyngitis and Invasive Disease in Colorado, USA, June 2016- April 2017. J Infect Dis. 2022;225(10):1841-51.
- Shea PR, Beres SB, Flores AR, Ewbank AL, Gonzalez-Lugo JH, Martagon-Rosado AJ, et al. Distinct signatures of diversifying selection revealed by genome analysis of respiratory tract and invasive bacterial populations. Proc Natl Acad Sci U S A. 2011;108(12):5039-44.
- Tomasdottir IA, Erlendsdottir H, Kristinsdottir I, Kristinsson KG, Haraldsson A, Beres SB, et al. A Striking Increase in Carriage Among Young Children in Iceland Paralleled the Unprecedented Increase of Invasive Group A Streptococcal Infection From 2022 to 2023. Pediatr Infect Dis J. 2025;44(7):616-21.
- Bessen DE. Tissue tropisms in group A Streptococcus: what virulence factors distinguish pharyngitis from impetigo strains? Curr Opin Infect Dis. 2016;29(3):295-303.
- Cunningham MW. Pathogenesis of group A streptococcal infections. Clin Microbiol Rev. 2000;13(3):470-511.
- Su M-W, Cheng YL, Lin YS, Wu JJ. Interplay between group A Streptococcus and host innate immune responses. Microbiol Mol Biol Rev. 2024;88(1):e0005222.
- Dolan G, Coelho J, Ryan Y, Scott A, Milburn M, Settle C, et al. Protracted cluster of Group A Streptococcal infection among individuals receiving wound care in the community, North East England, 2022: an outbreak report. Antimicrob Steward Healthc Epidemiol. 2025;5(1):e79.
- Cummins A, Millership S, Lamagni T, Foster K. Control measures for invasive group A streptococci (iGAS) outbreaks in care homes. J Infect. 2012;64(2):156-61.
- Vieira A, Wan Y, Ryan Y, Li HK, Guy RL, Papangeli M, et al. Rapid expansion and international spread of M1(UK) in the post-pandemic UK upsurge of Streptococcus pyogenes. Nat Commun. 2024;15(1):3916.
- Factor SH, Levine OS, Schwartz B, Harrison LH, Farley MM, McGeer A, et al. Invasive group A streptococcal disease: risk factors for adults. Emerg Infect Dis. 2003;9(8):970-7.
- Valenciano SJ, Onukwube J, Spiller MW, Thomas A, Como-Sabetti K, Schaffner W, et al. Invasive Group A Streptococcal Infections Among People Who Inject Drugs and People Experiencing Homelessness in the United States, 2010-2017. Clin Infect Dis. 2021;73(11):e3718-e26.
- de Gier B, van de Kassteele J, van Asten L, Schoffelen AF, Hooiveld M, Te Wierik MJ, et al. Attribution of invasive group A streptococcal infections (iGAS) to predisposing viral infections, the Netherlands, 2010 to 2023. Euro Surveill. 2024;29(40).
- Mariani F, Gentili C, Pulcinelli V, Martino L, Valentini P, Buonsenso D. State of the Art of Invasive Group A Streptococcus Infection in Children: A Scoping Review of the Literature with a Focus on Predictors of Invasive Infection. Children (Basel). 2023;10(9).
- Cohen JF, Bertille N, Cohen R, Chalumeau M. Rapid antigen detection test for group A streptococcus in children with pharyngitis. Cochrane Database Syst Rev. 2016;7(7):Cd010502.
- National Institute for Health and Excellence. Rapid tests for group A streptococcal infections in people with a sore throat. Diagnostic guidance, 13 nov. Hämtad: https://www.nice.org.uk/guidance/dg38. 2019.
- Jespersen MG, Lacey JA, Tong SYC, Davies MR. Global genomic epidemiology of Streptococcus pyogenes. Infect Genet Evol. 2020;86:104609.
- Ralph AP, Carapetis JR. Group a streptococcal diseases and their global burden. Curr Top Microbiol Immunol. 2013;368:1-27.
- Lappin E, Ferguson AJ. Gram-positive toxic shock syndromes. Lancet Infect Dis. 2009;9(5):281-90.
- Cleary PP, Kaplan EL, Handley JP, Wlazlo A, Kim MH, Hauser AR, et al. Clonal basis for resurgence of serious Streptococcus pyogenes disease in the 1980s. Lancet. 1992;339(8792):518-21.
- Nasser W, Beres SB, Olsen RJ, Dean MA, Rice KA, Long SW, et al. Evolutionary pathway to increased virulence and epidemic group A Streptococcus disease derived from 3,615 genome sequences. Proc Natl Acad Sci U S A. 2014;111(17):E1768-76.
- Liu Y, Chan TC, Yap LW, Luo Y, Xu W, Qin S, et al. Resurgence of scarlet fever in China: a 13-year population-based surveillance study. Lancet Infect Dis. 2018;18(8):903-12.
- Luk EY, Lo JY, Li AZ, Lau MC, Cheung TK, Wong AY, et al. Scarlet fever epidemic, Hong Kong, 2011. Emerg Infect Dis. 2012;18(10):1658-61.
- Lynskey NN, Jauneikaite E, Li HK, Zhi X, Turner CE, Mosavie M, et al. Emergence of dominant toxigenic M1T1 Streptococcus pyogenes clone during increased scarlet fever activity in England: a population-based molecular epidemiological study. Lancet Infect Dis. 2019;19(11):1209-18.
- UK Health Security Agency UHS. Research and analysis - Group A streptococcal infections: 15th update on seasonal activity in England. Updated 29 June 2023. 2023.
- Folkhälsomyndigheten. Betahemolytiska grupp A-streptokocker (invasiv) – sjukdomsstatistik. Folkhälsomyndighetens webbplats. Hämtad: https://www.folkhalsomyndigheten.se/folkhalsorapportering-statistik/hitta-statistik-och-data/betahemolytiska-grupp-a-streptokocker-gas-invasiv/. 2025.
- Johannesen TB, Munkstrup C, Edslev SM, Baig S, Nielsen S, Funk T, et al. Increase in invasive group A streptococcal infections and emergence of novel, rapidly expanding sub-lineage of the virulent Streptococcus pyogenes M1 clone, Denmark, 2023. Euro Surveill. 2023;28(26).
- Jain N, Lansiaux E, Reinis A. Group A streptococcal (GAS) infections amongst children in Europe: Taming the rising tide. New Microbes New Infect. 2023;51:101071.
- CDC. Increase in Pediatric Invasive Group A Streptococcal Infections. CDC, Communicable Disease Center and Control Health Alert Network, CDCHAN-00484. Dec 22. 2022.
- WHO. Increase in invasive Group A streptococcal infections among children in Europe, including fatalities. WHO, World Health Organisation, 12 dec. Hämtad: https://www.who.int/europe/news/item/12-12-2022-increase-in-invasive-group-a-streptococcal-infections-among-children-in-europe--including-fatalities. 2022.
- Nygaard U, Hartling UB, Munkstrup C, Nielsen AB, Dungu KHS, Schmidt LS, et al. Invasive group A streptococcal infections in children and adolescents in Denmark during 2022-23 compared with 2016-17 to 2021-22: a nationwide, multicentre, population-based cohort study. Lancet Child Adolesc Health. 2024;8(2):112-21.
- Rümke LW, Davies MA, Vestjens SMT, van der Putten BCL, Bril-Keijzers WCM, van Houten MA, et al. Nationwide upsurge in invasive disease in the context of longitudinal surveillance of carriage and invasive Streptococcus pyogenes 2009-2023, the Netherlands: a molecular epidemiological study. J Clin Microbiol. 2024;62(10):e0076624.
- Flamant A, Demirjian A, Lamagni T, Toubiana J, Smeesters PR, Cohen JF. Invasive group A streptococcal infections: lessons learned from the 2022-23 upsurge. Lancet Infect Dis. 2025.
- Davies MA, de Gier B, Guy RL, Coelho J, van Dam AP, van Houdt R, et al. Streptococcus pyogenes emm Type 3.93 Emergence, the Netherlands and England. Emerg Infect Dis. 2025;31(2):229-36.
- Folkhälsomyndigheten och SVA. Swedres-Svarm. Folkhälsomyndigheten och SVA. Hämtad: https://www.sva.se/djurhaelsa/antibiotika/oevervakning/swedres-svarm/. 2025.
- Darenberg J, Luca-Harari B, Jasir A, Sandgren A, Pettersson H, Schalén C, et al. Molecular and clinical characteristics of invasive group A streptococcal infection in Sweden. Clin Infect Dis. 2007;45(4):450-58.
- Lamagni TL, Efstratiou A, Vuopio-Varkila J, Jasir A, Schalén C, Strep E. The epidemiology of severe Streptococcus pyogenes associated disease in Europe. Euro Surveill. 2005;10(9):9-10.
- Luca-Harari B, Darenberg J, Neal S, Siljander T, Strakova L, Tanna A, et al. Clinical and microbiological characteristics of severe Streptococcus pyogenes disease in Europe. J Clin Microbiol. 2009;47(4):1155-65.
- White BP, Siegrist EA. Increasing clindamycin resistance in group A streptococcus. Lancet Infect Dis. 2021;21(9):1208-09.
- Li Y, Rivers J, Mathis S, Li Z, McGee L, Chochua S, et al. Continued Increase of Erythromycin Nonsusceptibility and Clindamycin Nonsusceptibility Among Invasive Group A Streptococci Driven by Genomic Clusters, United States, 2018-2019. Clin Infect Dis. 2023;76(3):e1266-e9.
- CDC. ABCs Bact Facts Interactive Data Dashboard. U.S. Centerss for Disease Prevention Control and Prevention. Hämtad: https://www.cdc.gov/abcs/bact-facts/data-dashboard.html. 2025.
- Lamagni T, Guy R, Chand M, Henderson KL, Chalker V, Lewis J, et al. Resurgence of scarlet fever in England, 2014-16: a population-based surveillance study. Lancet Infect Dis. 2018;18(2):180-7.
- Goldsmith JJ, Vu C, Zhu Z, MacLachlan JH, Thomson TN, Campbell PT, et al. The associations between invasive group A streptococcal disease and infection with influenza, varicella, or hepatitis C viruses: A data linkage study, Victoria, Australia. Int J Infect Dis. 2024;141:106969.
- de Gier B, Vlaminckx BJM, Woudt SHS, van Sorge NM, van Asten L. Associations between common respiratory viruses and invasive group A streptococcal infection: A time-series analysis. Influenza Other Respir Viruses. 2019;13(5):453-58.
- Musumeci S, MacPhail A, Weisser Rohacek M, Erba A, Goldenberger D, Lang C, et al. Role of viral coinfection in post-pandemic invasive Group A streptococcal infections in adults, a nation-wide cohort study (iGASWISS). Eur J Clin Microbiol Infect Dis. 2025.
- Shaw D, Abad R, Amin-Chowdhury Z, Bautista A, Bennett D, Broughton K, et al. Trends in invasive bacterial diseases during the first 2 years of the COVID-19 pandemic: analyses of prospective surveillance data from 30 countries and territories in the IRIS Consortium. Lancet Digit Health. 2023;5(9):e582-e93.
- SCB. Sveriges framtida befolkning 2022–2070, Statistiska Centralbyrån. Demografiska rapporter 2022:4. 2022.
- CDC. Decision Tool for Investigating Group A Streptococcus Infections in Long-Term Care Facilities. Centers for Disease Control and Prevention, National Center for Immunization and Respiratory Diseases. 2024.
- UK Health Security Agency. UK guidelines for the management of contacts of invasive group A streptococcus (iGAS) infection in community settings. Version 2.0. March 2023. GOV-14237. 2023.
- SVT Nyheter. Fyra döda efter bakterieutbrott på äldreboende. 13 maj 2016. Hämtad från: https://www.svt.se/nyheter/lokalt/stockholm/tre-doda-efter-bakterieutbrott-pa-aldreboende. 2016.
- Kolmos HJ, Svendsen RN, Nielsen SV. The surgical team as a source of postoperative wound infections caused by Streptococcus pyogenes. J Hosp Infect. 1997;35(3):207-14.
- Talbot TR, May AK, Obremskey WT, Wright PW, Daniels TL. Intraoperative patient-to-healthcare-worker transmission of invasive group A streptococcal infection. Infect Control Hosp Epidemiol. 2011;32(9):924-26.
- Hayama B, Harada S, Suzuki M, Doi Y, Nomura Y, Aoki K, et al. Outbreak of Streptococcus pyogenes emm89 ST646 in a head and neck surgical oncology ward. Microbiol Spectr. 2024;12(5):e0426023.
- Al-ajmi JA, Hill P, C OB, Garcia ML, Malkawi M, George A, et al. Group A Streptococcus Toxic Shock Syndrome: An outbreak report and review of the literature. J Infect Public Health. 2012;5(6):388-93.
- Region Skåne. Lasarettet i Landskrona återupptar sin operationsverksamhet, pressmeddelande från Region Skåne. Hämtat: https://press.newsmachine.com/pressrelease/view/lasarettet-i-landskrona-aterupptar-sin-operationsverksamhet-51862. 2012.
- Steer JA, Lamagni T, Healy B, Morgan M, Dryden M, Rao B, et al. Guidelines for prevention and control of group A streptococcal infection in acute healthcare and maternity settings in the UK. J Infect. 2012;64(1):1-18.
- Chandler RE, Lee LE, Townes JM, Taplitz RA. Transmission of group A Streptococcus limited to healthcare workers with exposure in the operating room. Infect Control Hosp Epidemiol. 2006;27(11):1159-63.
- Läkartidningen. Utbrott av barnsängsfeber på två förlossningsavdelningar. 13 dec 2019. Hämtad: https://lakartidningen.se/vetenskap/utbrott-av-barnsangsfeber-pa-tva-forlossningsavdelningar/. 2019.
- Region Stockholm. Betahemolyserande streptokocker grupp A (GAS) hos nyförlöst kvinna eller nyfött barn. Vårdgivarguiden, Vårdhygien Stockholm. 31 oktober 2023. Hämtad: https://vardgivarguiden.se/globalassets/kunskapsstod/vardhygien/smittamne-handlingsprogram-och-riktlinjer/betahemolytiska-streptokocker-grupp-a-gas.pdf?IsPdf=true. 2023.
- Läkartidningen. Ökande antal svårt sjuka av grupp A-streptokocker. 28 maj 2013. Hämtad: https://lakartidningen.se/vetenskap/okande-antal-svart-sjuka-av-grupp-a-streptokocker/. 2013.
- UK Health Security Agency. Guidelines for the public health management of scarlet fever outbreaks in schools, nurseries and other childcare settings. January 2023. GOV-13942. 2023.
- Katzenell U, Shemer J, Bar-Dayan Y. Streptococcal contamination of food: an unusual cause of epidemic pharyngitis. Epidemiol Infect. 2001;127(2):179-84.
- Falkenhorst G, Bagdonaite J, Lisby M, Madsen SB, Lambertsen L, Olsen KE, et al. Outbreak of group A streptococcal throat infection: don't forget to ask about food. Epidemiol Infect. 2008;136(9):1165-71.
- Karabela Ş N, Şenoğlu S, Altuntaş Aydin Ö, Baydili KN, Aksu Ö, Kart Yaşar K. Foodborne streptococcal tonsillopharyngitis outbreak in a hospital. Cent Eur J Public Health. 2022;30(4):225-29.
- Asteberg I, Andersson Y, Dotevall L, Ericsson M, Darenberg J, Henriques-Nordmark B, et al. A food-borne streptococcal sore throat outbreak in a small community. Scand J Infect Dis. 2006;38(11-12):988-94.
- Bubba L, Bundle N, Kapatai G, Daniel R, Balasegaram S, Anderson C, et al. Genomic sequencing of a national emm66 group A streptococci (GAS) outbreak among people who inject drugs and the homeless community in England and Wales, January 2016-May 2017. J Infect. 2019;79(5):435-43.
- Mearkle R, Saavedra-Campos M, Lamagni T, Usdin M, Coelho J, Chalker V, et al. Household transmission of invasive group A Streptococcus infections in England: a population-based study, 2009, 2011 to 2013. Euro Surveill. 2017;22(19).
- Watts V, Balasegaram S, Brown CS, Mathew S, Mearkle R, Ready D, et al. Increased Risk for Invasive Group A Streptococcus Disease for Household Contacts of Scarlet Fever Cases, England, 2011-2016. Emerg Infect Dis. 2019;25(3):529-37.
- Andersson M, Pallon J, Cronberg O, Sundqvist M, Hedin K. Seasonal variations in use and outcome of rapid antigen detection tests and cultures in pharyngotonsillitis: a register study in primary care. BMC Infect Dis. 2021;21(1):1104.
- Lee MH, Lee GA, Lee SH, Park YH. A systematic review on the causes of the transmission and control measures of outbreaks in long-term care facilities: Back to basics of infection control. PLoS One. 2020;15(3):e0229911.
- Murillo T, Mangal K, Barmada G, Morris T, Waggle KD, Griffith M, et al. Transmission of group A Streptococcus in long-term care: An outbreak investigation. Am J Infect Control. 2025;53(4):530-2.
- Public Health England. Invasive group A streptococcal outbreaks associated with community health services delivered at home, January 2018 to September 2019. Public Health England, Storbritannien. September 2021. GOV-9246. 2021.
- Health IDo. Group A Streptococcus in long-term care facilities. Indiana Department of Health, Infectious Disease Epidemiology and Prevention Division. February 13, 2023. 2023.
- Walter ND, Taylor TH, Jr., Dowell SF, Mathis S, Moore MR. Holiday spikes in pneumococcal disease among older adults. N Engl J Med. 2009;361(26):2584-85.
- Hoogendijk IV, de Zwart-Slats D, Boers SA, van der Putten BCL, van Sorge NM, Molenaar BDH, et al. Value of collaborative investigation by hospital infection control, public health services and a national reference laboratory during an increase in puerperal sepsis. Antimicrob Resist Infect Control. 2025;14(1):60.
- Watts V, Usdin M, Mearkle R, Sriskandan S, Cordery R, Millership S, et al. Antibiotic chemoprophylaxis for close contacts of invasive group A streptococcus in community settings: Evidence review. J Infect. 2025;90(4):106468.
- Walkinshaw DR, Wright MEE, Mullin AE, Excler JL, Kim JH, Steer AC. The Streptococcus pyogenes vaccine landscape. NPJ Vaccines. 2023;8(1):16.
- Frère J, Bidet P, Tapiéro B, Rallu F, Minodier P, Bonacorsi S, et al. Clinical and Microbiological Characteristics of Invasive Group A Streptococcal Infections Before and After Implementation of a Universal Varicella Vaccine Program. Clin Infect Dis. 2016;62(1):75-77.
- Lee SE, Eick A, Bloom MS, Brundage JF. Influenza immunization and subsequent diagnoses of group A streptococcus-illnesses among U.S. Army trainees, 2002-2006. Vaccine. 2008;26(27-28):3383-86.
Bilaga 1. Extern referensgrupp
Representanter från följande specialistföreningar, organisationer och myndigheter har ingått i en extern referensgrupp för det här underlaget:
- Föreningen för Klinisk Mikrobiologi
- Läkemedelsverket
- Nationell arbetsgrupp Strama
- Nationell arbetsgrupp Vårdhygien
- Smittskyddsläkarföreningen
- Svensk Barninfektionsförening
- Svenska Infektionsläkarföreningen
- Svensk Förening för Allmänmedicin
- Svensk Förening för Vårdhygien
- Svenska Hygienläkarföreningen
- Svensk Smittskyddssjuksköterskeförening
Bilaga 2. Epidemiologisk analys
Uppgiftskällor och datahantering
Den deskriptiva analysen av det epidemiologiska läget av iGAS-fall i Sverige är baserad på data från den ordinarie övervakningen av iGAS samt tillgängliga register. Studiepopulationen består av alla iGAS-fall som rapporterats i Sverige mellan den 1 januari 2015 och den 30 juni 2025.
Källorna består av uppgifter från Sminet (bekräftade fall av iGAS, samt om de fallen även har rapporterade fall av covid-19 och influensa), Skatteverket (datum för dödsfall), Socialstyrelsen (SÄBO, hemtjänst, diagnoser i slutenvård och specialiserad öppenvård (scharlakansfeber, vattkoppor, akut faryngit, akut tonsillit), SCB (antal hemmaboende barn, antal per åldersgrupp) samt data från Svebar på fynd av GAS i svalgodlingar. Information om SÄBO, hemtjänst och SCB-bakgrundsvariabler finns endast tillgänglig från och med 2019 och framåt, eftersom de uppgifterna samlas in som en del av arbetet med covid-19.
Nämnare för befolkningsbaserade analyser hämtades i augusti 2025 från flera källor. Totala befolkningsuppgifter och åldersgruppsfördelningar kommer från månadsdata publicerade av Statistiska centralbyrån (SCB), där de senaste tillgängliga uppgifterna sträcker sig fram till maj 2025. Nämnare för personer som bor på SÄBO och personer som får hemtjänst hämtades från månadsdata publicerade av Socialstyrelsen. Dessa uppgifter avser endast personer från 65 år och uppåt och var tillgängliga fram till mars 2025. Nämnare för SCB-bakgrundsvariabler kommer från månads- eller årsvisa siffror från SCB, med data tillgängliga fram till december 2024.
Definitioner
iGAS-säsong: En säsong definieras som juli–juni.
iGAS-datum: Sminets statistikdatum.
covid-19-datum: Sminets statistikdatum.
influensadatum: Sminets statistikdatum används för influensa typ A (H1)pdm09, influensa typ A (ej subtypad), influensa typ A (H3), influensa B (Yamagata), influensa B (Victoria) eller influensa B (utan subtyp).
iGAS-dödsdatum: registrerad som avliden 10 dagar före iGAS-datum eller inom 30 dagar efter iGAS-datum. I ett fåtal fall har diagnosdatum eller provtagningsdatum använts istället för iGAS-datum.
covid-19 co-infektion: covid-19-datum som infaller inom två veckor före till två veckor efter iGAS-datum.
influensa co-infektion: influensadatum som infaller inom två veckor före till två veckor efter iGAS-datum.
boende på SÄBO: ett iGAS-fall klassificeras som boende på SÄBO om iGAS-datumet inträffade efter det första beslutet om att personen ska bo särskilt boende för äldre. Denna definition antar att personer som tas in på äldreboende förblir där under resten av sitt liv.
hemtjänst: ett iGAS-fall klassificeras som mottagande av hemtjänst om iGAS-datumet inträffade efter beslutet om att personen ska få hemtjänst och om personen därefter inte flyttade till ett äldreboende innan iGAS-datum (de klassificeras som SÄBO i sådana fall).
Metod
Deskriptiv epidemiologi
En beskrivande epidemiologisk analys genomfördes för att karakterisera fördelningen av fall. Resultatet sammanfattades med frekvenstal, andelar och incidensrater (per 100 000 individer).
Incidensen av iGAS bland personer som bor på SÄBO och personer som får hemtjänst under perioden 2019–2025 uppskattades med hjälp av Socialstyrelsens nämnardata över antalet personer 65 år och äldre som bor i SÄBO eller får hemtjänst per månad, tillsammans med SCB:s data över antal personer per åldersgrupp.
För att uppskatta den årliga incidensen av iGAS bland vuxna i åldern 18–50 år, indelade efter antal samboende barn (0, 1, 2 eller 3+ barn) i Sverige under perioden 2019–2024, användes befolkningsdata från Statistiska centralbyrån (SCB). För varje år och barnkategori beräknades 95-procentiga konfidensintervall genom att modellera antalet fall med hjälp av Poisson-regression med en log-transformerad offset för befolkningsnämnaren.
Negativ binomial regression
För trendanalys användes en generell regressionsmodell med tiden som förklarande variabel och utfallet är antal fall justerat för befolkningsstorleken i Sverige vid varje tidpunkt (det vill säga med antalet fall som utfallsvariabel och befolkningsstorlek som nämnardata). Observerad och anpassad incidens mellan åren 2005 till 2024 med 95 procentiga konfidensintervall för incidenskvot samt p-värde beräknades.
Multivariabel logistisk regression
Logistisk regression användes för att identifiera riskgrupper och sammanhang associerade till död bland iGAS-fall, med data från februari 2020 till och med juni 2025. Utfallsvariabeln var död inom 30 dagar efter iGAS-datumet (ja/nej). Justerade oddskvoter (adjusted odds ratios, AOR) och 95-procentiga konfidensintervall (KI) beräknades. Oddskvoter som är större än 1 och har KI som inte sträcker sig över 1 innebär att det, efter justering för de andra variablerna i modellen, finns en högre odds för död jämfört med referensgruppen. Referensgrupper: åldersgrupp 18–29 år, inte SÄBO, inte hemtjänst, ingen co-infektion, kvinnor.
| Variabel/faktor | Antal fall (n=4025) | Antal dödsfall inom 30 dagar (n=425) | Ojusterad oddskvot | 95% KI | Justerad oddskvot | 95% KI |
|---|---|---|---|---|---|---|
| 0–9 år | 372 | 10 | 1,48 | 0,62–3,39 | 1,49 | 0,63–3,42 |
| 10–19 år | 111 | 5 | 2,52 | 0,80–6,84 | 2,53 | 0,80–6,87 |
| 20–39 år (ref) | 708 | 13 | ref | ref | ref | ref |
| 40–69 år | 1387 | 92 | 3,80 | 2,19–7,16 | 3,54 | 2,03–6,70 |
| 70+ år | 1447 | 305 | 14,28 | 8,48–26,38 | 9,29 | 5,36–17,51 |
| Kvinna (ref) | 2003 | 206 | Ref | Ref | Ref | Ref |
| Man | 2022 | 219 | 1,06 | 0,87–1,30 | 1,00 | 0,80–1,24 |
| Inte SÄBO (ref) | 3817 | 348 | Ref | Ref | Ref | Ref |
| SÄBO | 208 | 77 | 5,86 | 4,32–7,91 | 3,7 | 2,60–5,20 |
| Inte hemtjänst (ref) | 3330 | 282 | Ref | Ref | Ref | Ref |
| Hemtjänst | 695 | 143 | 2,80 | 2,24–3,49 | 1,74 | 1,33–2.26 |
| Ingen covid-19 co-infektion (ref) | 3885 | 399 | Ref | Ref | Ref | Ref |
| Covid-19 co-infektion | 140 | 26 | 1,99 | 1,26–3,04 | 1,65 | 1,01–2,59 |
| Ingen influensa co-infektion (ref) | 3890 | 411 | Ref | Ref | Ref | Ref |
| Influensa co-infektion | 135 | 14 | 0,98 | 0,53–1,66 | 1,62 | 0,86–2,83 |
