
Tillgänglighet till vissa antibiotika – Fortsatta erfarenheter från en tidigare pilottestad ersättningsmodell
Sammanfattning
Folkhälsomyndigheten har genomfört ett uppdrag om att fortsatt öka tillgängligheten till vissa antibiotika av särskilt medicinskt värde. Uppdraget bygger på en modell för garanterad ersättning till läkemedelsföretag för tillhandahållande av vissa nya antibiotikaprodukter, som myndigheten tidigare tagit fram och testat i en pilotstudie.
Modellen för garanterad ersättning har utvecklats baserat på tidigare erfarenheter
Myndigheten har i detta uppdrag utvecklat modellen för garanterad ersättning baserat på erfarenheter från en tidigare genomförd pilotstudie. Det inkluderar justeringar för lagervolym, ökad ersättning, lagerincitament, och tydliggörande av modellens avsikt.
Avtal om tillgänglighet till två antibiotikaprodukter har tecknats
En upphandling genomfördes, enligt lag (2016:1145) om offentlig upphandling (LOU), av tillgänglighet till nya antibiotikaprodukter avsedda för användning inom slutenvården. Upphandlingen resulterade i avtal för två antibiotikaprodukter som uppfyllde de uppställda kraven: Recarbrio (imipenem, cilastatin och relebaktam) och Zavicefta (avibaktam och ceftazidim).
Upphandlingen genomfördes med flera tilldelade leverantörer baserat på en lägsta årlig ersättning. Kraven inkluderade bland annat god tillgång, avsedd effekt, säkerhetsprofil, och specifika indikationer. Avtalen gällde perioden 1 oktober 2023 till den 31 december 2023, och har förlängts till den 31 december 2024.
Sammanfattande rekommendation
Folkhälsomyndigheten föreslår att den nuvarande ersättningsmodellen, med delvis frikopplad ersättning från försäljning, permanentas eller förlängs genom offentligt finansierad ersättning för att säkra tillgänglighet till vissa nya antibiotika. Myndigheten rekommenderar att Folkhälsomyndigheten får ett uppdrag för att upphandla, förvalta och utveckla modellen långsiktigt. I detta arbete ingår även att aktivt dela Sveriges erfarenheter till andra länder och initiativ, samt beakta och delta i den nordiska och europeiska diskussionen på området.
Summary
The Public Health Agency of Sweden was commissioned by the government to continue to strengthen the availability of certain antibiotics of particular medical value. The assignment is based on experiences gained from the development and piloting of a new model for guaranteed reimbursement to pharmaceutical companies for the availability of certain new antibiotic products.
The model for guaranteed reimbursement has been updated based on conclusions from a previous pilot study
The model for guaranteed reimbursement was selectively updated based on experiences from a previous pilot study. This includes adjustments regarding the stock volume, increased compensation, changes in stock incentives, and clarification of the model's intent.
An agreement on the availability of two antibiotic products has been signed
The availability of new antibiotic products intended for use in inpatient care was procured. The procurement process resulted in agreements with two pharmaceutical companies for two antibiotic products that met the set requirements: Recarbrio (imipenem, cilastatin and relebactam) and Zavicefta (avibactam and ceftazidime).
The requirements included, but were not limited to, good access, intended effect, safety profile, and specific indications. The agreements were valid for the period 1 October 2023 to 31 December 2023, and was extended to 31 December 2024.
Recommendation
The Public Health Agency of Sweden proposes that the current reimbursement model, with partially de-linked compensation, should be made permanent or extended to ensure availability of certain new antibiotics. The agency recommends that the Public Health Agency of Sweden should be given the task to procure, manage and develop the model in the long term. This work also includes actively sharing Sweden's experiences with other countries and initiatives, as well as taking into account and participating in the Nordic and European discussion regarding this issue.
Om publikationen
Denna rapport baseras på Folkhälsomyndighetens slutrapportering av regeringsuppdraget Att fortsatt öka tillgängligheten till vissa antibiotika (S2023/01709 (delvis)).
Antalet infektionsfall med svårbehandlade multiresistenta bakterier ökar i Sverige och tillgången till specifik antibiotika är avgörande för utgången för patienten. Sverige är en liten marknad och nya antibiotikaprodukter tenderar att introduceras sent eller aldrig. Rapporten beskriver hur Folkhälsomyndigheten genom en genomförd upphandling har säkrat tillgänglighet till vissa av dessa produkter för svensk sjukvård. Detta utifrån en modell för garanterad ersättning till läkemedelsföretag som justerats baserat på erfarenheter från Folkhälsomyndighetens tidigare pilotstudie inom uppdraget Att genomföra en pilotstudie om tillgänglighet till vissa antibiotika (S2018/03920/FS (delvis)).
Rapporten beskriver också utvecklings och utvärderingsinsatser och förslag på arbetet framåt.
Folkhälsomyndigheten
Agneta Falk Filipsson
Tillförordnad avdelningschef, Avdelningen för smittskydd och hälsoskydd
Ordlista
Aktiv substans – det ämne i ett läkemedel som ger det dess medicinska effekt.
Antibiotika av särskilt medicinskt värde – i denna rapport avses de antibiotika som har identifierats med att ha risk för otillräcklig tillgänglighet och som bedöms som särskilt medicinskt värdefulla att säkerställa tillgången till. Bedömningen baseras på aktivitetsprofil, tillgängliga alternativ, plats i terapin, ekologisk profil och specifik styrka eller formulering.
Marknadsskydd – om en produkt har marknadsskydd är det inte tillåtet för andra företag att börja sälja en motsvarande generisk produkt. Denna period är oftast 10 år efter ett nationellt eller centralt marknadsgodkännande.
Produkt – avser i denna rapport ett antibiotika med en viss aktiv substans eller substanskombination, beredningsform och styrka.
Produktlivscykel – avser i denna rapport tiden från en läkemedelsprodukt erhållit marknadsgodkännande tills att den avregistreras och/eller slutar tillhandahållas på en marknad.
Pull-incitament – ekonomiskt incitament för att ge de företag som sätter en ny produkt på marknaden en ersättning som är helt eller delvis frikopplad från den framtida försäljningsvolymen.
Push-mekanismer – syftar till att stimulera forskning och utveckling, och ska underlätta arbetet med att få fram nya läkemedelskandidater som kan utgöra grunden för fortsatt läkemedelsforskning.
Regioner – det som fram till 2019 kallades för landsting.
Rekvisitionsantibiotika – antibiotika som i Sverige köps av vårdgivarna och ges på sjukhus eller i övrigt vid vårdbesök.
Slutenvård – vård som bedrivs då patienten ligger på sjukhus.
Stewardship – samordnade insatser med avsikt att mäta och förbättra ändamålsenlig användning av antibiotika genom optimal antibiotikabehandling inklusive dosering, behandlingstidens längd och administreringsväg.
Äldre antibiotika – antibiotika där marknadsexklusiviteten gått ut (normalt minst 10 år sen första registrering) och där flertal utbytbara generikaprodukter kan förekomma.
Förkortningar
AMR – antimikrobiell resistens. I det här arbetet avses främst antibiotikaresistens hos bakterier.
EU – Europeiska unionen
EU-JAMRAI 2 - European Union Joint Action on Antimicrobial Resistance and Healthcare-Associated Infections 2
HERA – Europeiska myndigheten för beredskap och insatser vid hälsokriser (Health Emergency Preparedness and Response Authority)
LOU – Lag (2016:1145) om offentlig upphandling
LV – Läkemedelsverket
MA – marknadsföringstillstånd (Market Authorisation)
TLV – Tandvårds- och läkemedelsförmånsverket
PHAC – Public Health Agency of Canada
WHO – Världshälsoorganisationen (World Health Organization)
Bakgrund
Antimikrobiell resistens (AMR), i synnerhet antibiotikaresistens, medför ökade kostnader för samhället och har negativa följder för arbetet med hållbar utveckling världen över. AMR är enligt World Health Organization (WHO) ett av de största globala hälsohoten. Sverige har ett jämförelsevis gott resistensläge, bland annat tack vare ett långvarigt aktivt engagemang av flera nationella och lokala aktörer, bland annat genom myndighetssamverkan och lokala Stramagrupper. All användning av antibiotika driver resistensutvecklingen och det är därför av största vikt att antibiotika endast används när det behövs och så ansvarsfullt som möjligt.
Ett brett, och tillgängligt, sortiment av antibiotika är en förutsättning för att bedriva en modern sjukvård och bromsa utvecklingen av resistenta bakterier. Utan tillgång till nya antibiotika riskeras hälsan för patienter inom den svenska sjukvården, särskilt de som genomgår cancerbehandlingar och transplantationer samt nyfödda.
Sverige, som ur ett globalt perspektiv, är en liten marknad för läkemedel, inklusive nya antibiotika, riskerar att inte vara prioriterat för marknadsföring och tillgängliggörande av de senaste läkemedlen från företagens sida.
Insatser för ökad tillgång till antibiotika är en viktig del i arbetet mot antibiotikaresistens, och finns med i flera styrdokument på området så som den myndighetsgemensamma handlingsplanen mot antibiotikaresistens 2021– 2024 som tagits fram av den nationella samverkansfunktionen (1), regeringens nationella strategi för arbetet mot antibiotikaresistens (2), Europeiska kommissionens sektoröverskridande handlingsplan mot antibiotikaresistens (3), Europeiska kommissionens rådsrekommendationer om intensifiering av EU:s åtgärder för att bekämpa antimikrobiell resistens genom en One health-modell (4), Europeiska kommissionens förslag på ny förordning och nytt direktiv för reform av EU:s läkemedelslagstiftning som presenterades i april 2023 (5) och den nyligen beslutade nationella läkemedelsstrategin med fokus på bland annat förbättrad tillgänglighet till nya och gamla läkemedel, där antibiotika lyfts fram som särskilt viktiga i sammanhanget (6).
Under det svenska EU-ordförandeskapet arrangerades ett högnivåmöte den 6-7 mars 2023 om antibiotikaresistens. Det rådde enighet om att det inte är en enstaka åtgärd som löser problemenen med forskning och utveckling av nya antibiotika, samt tillgången på nya och äldre antibiotika. Istället behövs en kombination av incitament för både ”push” och ”pull” som säkerställer hela kedjan i en ”end-to-end approach”, från grundforskning, via kliniska prövningar, till marknadsgodkännande och tillverkning och distribution, där ersättningsmodeller för nya och äldre kliniskt prioriterade antibiotika är en viktig del (7). Olika åtgärder för att säkra tillgång till antibiotika behövs och bör anpassas efter förutsättningarna för produkten i olika marknadsstadier av dess produktlivscykel.
Uppdraget
Regeringen gav i maj 2023 Folkhälsomyndigheten i uppdrag att fortsatt öka tillgängligheten till vissa antibiotika (S2023/01709 (delvis)) baserat på erfarenheterna från den modell för garanterad, delvis frikopplad, ersättning som tagits fram och pilottestats för att säkerställa tillgång till vissa antibiotika av särskilt medicinskt värde (8). Baserat på ersättningsmodellen upphandlade myndigheten inom ramen för tidigare regeringsuppdrag tillgång till fem antibiotika från fyra företag, flera vid tillfället nya på den svenska marknaden. Genom pilotstudien fick Sverige dessutom tillgång till samtliga fyra nyligen godkända antibiotika tidigare än andra jämförbara europeiska länder.
Regeringen gör bedömningen att det är angeläget att Folkhälsomyndigheten fortsatt skapar förutsättningar för att öka tillgängligheten till vissa särskilt medicinskt viktiga antibiotika baserat på erfarenheter från tidigare uppdrag.
Redovisningen av uppdraget till Regeringskansliet skulle enligt uppdragsbeskrivningen innehålla eventuella behov av fortsatta utvecklingsinsatser inom området och kostnadsberäkningar av dessa, en bedömning hur Folkhälsomyndigheten kan stödja detta arbete.
I slutrapporteringen av det tidigare uppdraget (S2018/03920 (delvis)) (8), 31 maj 2023, rekommenderade myndigheten att en modell likt den som testades i pilotstudien fortsatt ska användas framöver då den kan säkerställa tillgängligheten till särskilt medicinskt viktiga antibiotika på ett ändamålsenligt och effektivt sätt, utan att påverka marknaden på ett oönskat sätt, och att upphandlingen enligt LOU inte utgör ett otillåtet statsstöd. Folkhälsomyndighetens rekommendationer till regeringen präglades av långsiktighet bland annat i rekommendationen om att myndigheten bör få i uppdrag att upphandla tillgänglighet till nya antibiotika vid en förlängning eller permanentning av ersättningsmodellen med därtill hörande finansiering från staten.
Lärdomarna från pilotmodellen har varit en av utgångspunkterna i ett parallellt med detta, löpande, regeringsuppdrag där Folkhälsomyndigheten genomfört en förstudie om en ny ersättningsmodell för att tillhandahålla ett buffertlager av vissa äldre antibiotikaprodukter (S2023/02106 (delvis)) (9).
Vidare finns ett fortsatt stort intresse för pilotstudien och dess fortsättning på internationellt och nationellt håll, och det pågår ett aktivt arbete för att dela Sveriges och Folkhälsomyndighetens erfarenheter. Bland annat var Kanadas folkhälsomyndighet, Public Health Agency of Canada (PHAC), på besök hos Folkhälsomyndigheten i september 2023 för att ta del av de svenska erfarenheterna, då de ska bygga upp en ersättningsmodell anpassad till den kanadensiska kontexten. Besöket gav också myndigheten ökad förståelse vilka delar av den svenska modellen som är som kan vara utmanande för andra länder att implementera samt vilka som är enklare att utgå från vid uppbyggnad av en landspecifik ersättningsmodell.
Syfte
Syftet med uppdraget är att öka den nationella tillgängligheten till vissa antibiotika av särskilt medicinskt värde utifrån den modell för garanterad ersättning som tidigare tagits fram och testats i en pilotstudie av myndigheten. Målet är att patienterna och den svenska hälso- och sjukvården har tillgång till de mest ändamålsenliga behandlingsalternativen.
Avgränsningar
Förslag för statliga åtaganden som läggs inom uppdraget ska rymmas inom befintliga ramar. Uppdraget avser, liksom den tidigare pilotstudien, endast ett fåtal redan utvecklade rekvisitionsantibiotika, det vill säga antibiotika som används på sjukhus, som trots att de används relativt sällan har ett särskilt medicinskt värde (se första delen av slutrapportering av S2018/03920 (delvis) (10)). Uppdraget avser vardagsförsörjning av humanläkemedel och inte läkemedel för beredskapsändamål.
Metod
Folkhälsomyndigheten har i detta uppdrag utvecklat prioriterade delar av modellen för garanterad ersättning som myndigheten tagit fram och pilottestat, baserat på lärdomar och erfarenheter från pilotstudien (S2018/03920 (delvis)) (8).
Modellen har utvecklats avseende principer för lagervolym, en höjning av den garanterade ersättningsnivån, justering av lagerincitamentsdelen, samt ett antal justeringar för att tydliggöra vilket produktsegment modellen är avsedd för. Justeringarna baseras på resultat och erfarenhet från pilotstudien och dess följeforskning och ligger i linje med de förslag som lyfts till Regeringskansliet vid slutrapporteringen av det tidigare regeringsuppdraget (S2018/03920 (delvis)) (8).
Inom ramen för uppdraget genomförde myndigheten en upphandling av tillgänglighet till vissa antibiotikaprodukter i enlighet med LOU baserat på den justerade ersättningsmodellen. Upphandlingen avsåg antibiotikaprodukter av särskilt medicinskt värde inom samma medicinska kategori som tidigare vad gäller indikationer, bakteriellt spektrum och säkerhetsprofil.
Utöver de prioriterade delar av modellen som myndigheten utvecklat inom detta uppdrag, ges ett antal förslag på ytterligare utvecklings- och utvärderingsinsatser och beskrivning av det fortsatta arbetet med ersättningsmodellen, samt en bedömning hur Folkhälsomyndigheten kan stödja det arbetet.
Uppdragets genomförande
Folkhälsomyndigheten bedömde att de flesta principer som utarbetades under pilotstudien var ändamålsenliga och effektiva, men har i detta uppdrag utvecklat prioriterade delar av modellen för garanterad ersättning utifrån erfarenheterna från pilotstudien. Baserat på den justerade modellen har myndigheten genomfört en upphandling. Arbetet med justeringar och upphandlingen beskrivs nedan.
Justerade krav på lagervolym
Inom ramen för följeforskningen av pilotstudien drogs slutsatsen att modellen hade för omfattade krav på lagervolym. Den tidigare principen innebar att leverantören skulle säkra att lagrets storlek per kvartal motsvarade föregående kvartals försäljning gånger två, men att lagret minst skulle motsvara två veckors behandling vid respektive akutsjukhus i Sverige (65 stycken) av aktuell antibiotikaprodukt. Denna nivå sattes i samråd med kliniska experter för att representera ett värsta tänkbart medicinskt scenario som dessa lager skulle kunna täcka om behovet uppstod.
Erfarenheterna från pilotstudien visade på vikten av att teckna kontrakt för samtliga antibiotikaprodukter som uppfyllde de uppställda kriterierna, för att förebygga allvarliga kliniska konsekvenser av oförutsedda leveransproblem. Dock tog den tidigare principen för beräkning av volym inte hänsyn till att avtal för tillgänglighet kunde tecknas för flera antibiotikaprodukter. Med tanke på att fem produkter ingick i pilotstudien visade sig dessa volymkrav vara för stora för det faktiska medicinska behovet. För några av produkterna som hade väldigt låg försäljning innebar dessa krav att lagervolymerna var väldigt väl tilltagna. Snåriga avtal och komplexa regelverk gjorde det dessutom, enligt företagen, svårt att distribuera om produkter till andra marknader från de lager som byggts upp inom ramen för pilotstudien.
Kraven på lagervolym i kombination med svårigheterna att omfördela lagren föranledde oönskad kassation av stora volymer antibiotika som kunde ha använts i andra delar av världen. En viss kassation går inte att utesluta, men för att minimera denna så justerades principen för storleken på lagervolymen inför upphandlingen inom ramen för detta uppdrag.
Kraven i avtalet för lagervolym har justerats så att volymen anpassas till varje produkts tidigare försäljning med en extra säkerhetsmarginal, istället för att alla företag ska ha ständig beredskap i fysiskt lager för ett ”värsta medicinskt scenario”. Nu när piloten fortlöpt så finns försäljningsdata för samtliga antibiotikaprodukter på den svenska marknaden som kan användas för att göra en rimlig prognos framåt. Dock ska företagen alltid kunna leverera de volymer som efterfrågas kliniskt.
För produkter som är nya på marknaden och saknar tidigare försäljning ska lagervolymen motsvara 40 behandlingsdygn, och med den nya principen kommer denna volym att justeras successivt med den faktiska försäljningen.
Dessutom skiljer det sig hur ofta ett företag har möjlighet att återfylla lagret samt hur deras ledtider ser ut i den logistiska kedjan vilket också kommer påverka prognoserna för lagervolymen. Ansvaret för att beräkna vilken lagervolym som krävs för deras antibiotikaprodukt ligger på företaget men med kravet att de inkommer med underlag till Folkhälsomyndigheten som beskriver hur tillgängligheten för just deras produkt ska upprätthållas och garanteras enligt avtalet. Beskrivningen ska minst inkludera beräkning av säkerhetslagrets volym, frekvens för inleverans, leveranstid för återfyllnad samt lagerhållare. Om säkerhetsmarginalen visar sig vara för låg och att risk för bristande tillgänglighet uppstår har avtalet också kompletterats med en möjlighet att justera säkerhetsmarginalen efter dialog med företaget. Genom den justering som myndigheten nu gjort av principen för lagervolym följer att volymkravet blir oberoende av hur många produkter som myndigheten tecknar avtal om tillgänglighet för.
Höjning av ersättningsnivån
Genom nedan princip beräknades den garanterade årliga ersättningen ut inom pilotstudien (8), som då var maximalt 4 miljoner kronor.
Garanterad minsta ersättning = volym tillgänglighetslagret x pris per förpackning x 1,5
Utifrån nuvarande ekonomiska situation såg myndigheten behov av att justera ersättningsnivån då den varit samma sedan pilotstudiens start år 2018.
”Pris per förpackning” i formeln ovan baserades inom pilotstudien på ett medelpris för produkter inom det upphandlade området vid tidpunkten för den tidigare upphandlingen. Inom detta uppdrag användes istället antibiotikaprodukternas priser och försäljningssiffror i Sverige för beräkningen av ett pris per förpackning, vilket gör att modellen anpassas till den svenska kontexten ytterligare.
”Volym tillgänglighetslagret” i formeln baserades på ett uppskattat medicinskt behov utifrån ett värsta tänkbart medicinskt scenario, med syftet att klara oförutsägbara globala leveransproblem, och var också ett medelvärde baserat på produkter inom det upphandlade området. Denna princip användes även inom detta uppdrag eftersom upphandlingen syftar till att upphandla tillgänglighet till vissa antibiotika, och den tillgänglighet per produkt som vi ser att staten bör vara beredd att betala för är den tillgänglighet som motsvarar det värsta tänkbara medicinska scenariot.
Detta multiplicerades med en faktor på 1,5 för att ta höjd för ökade kostnader för bland annat logistik och administration för att delta i modellen, vilken behölls på samma nivå som tidigare.
Vid en ny beräkning av den maximala ersättningsnivån enligt tidigare princip hamnar den på 4,5 miljoner kronor. Det bedöms i praktiken låg sannolikhet att samtliga produkter skulle erhålla maximal ersättning då den faktiska försäljningen påverkar ersättningen, se formeln för att beräkna den årliga ersättningen från staten ovan. I modellen betalar regionerna för sin användning och staten för tillgänglighet, en princip som innebär att modellen säkerställer att regionernas val av behandlingar inte påverkas av ekonomiska konsekvenser av pilotstudien.
Två olika typer av lagerincitament
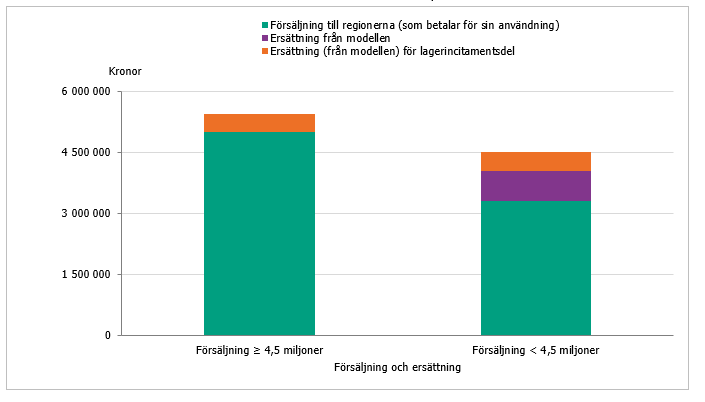
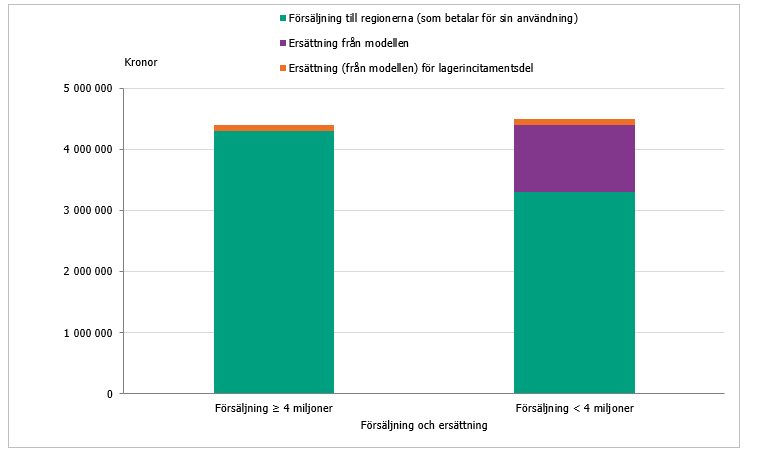
Samtliga företag erhöll inom pilotstudien en så kallad lagerincitamentsdel om 400 000 kronor årligen (10 procent av den maximala ersättningen) oavsett försäljning. I följeforskningen inom ramen för det tidigare regeringsuppdraget drogs slutsatsen att lagerincitamentsdelen spelade en nödvändig roll och kan ses som en extra ”pull-mekanism” som bör finnas kvar i en eventuell förlängning, men att nivån bör ses över inför varje upphandling för att motsvara kostnaderna på marknaden (8). Eftersom majoriteten av antibiotikaprodukterna i pilotstudien var helt nya på den svenska marknaden så kunde den tidigare nivån motiveras. För redan marknadsförda produkter minskar de administrativa kostnaderna. Inför upphandlingen inom detta uppdrag justerades därför lagerincitamentsdelen och delades upp i två varianter, vilka beskrivs nedan (se även figur 1 och 2):
- För produkter som marknadsförts på den svenska marknaden i minst ett år och har en försäljning som överstiger 4,0 miljoner kronor, får företaget en årlig ersättning om 100 000 kronor.
- För produkter som har marknadsförts mindre än ett år eller lanseras under avtalsperioden, har företaget under denna period rätt till en lagerincitamentsdel om 450 000 kronor, oaktat försäljning.
Gränsen på 4 miljoner valdes då denna nivå också är satt som inklusionskriterium i modellen; produkter med en årlig försäljning på över 4 miljoner kronor är inte aktuella för ersättningsmodellen. Om försäljningen för en produkt som inkluderats i modellen överskrider 4 miljoner kronor på ett år erhåller det marknadsförande företaget alltså endast lagerincitamentsdelen om 100 000 kronor, och inte mellanskillnaden upp till 4,5 miljoner kronor. Tanken är att denna del av ersättningen ska täcka vissa löpande fasta kostnader när en produkt etablerats på marknaden. Denna justering kombinerat med den höjda ersättningsnivån innebär att företag med låg försäljning erhåller större ersättning upp till gränsen på 4 miljoner kronor.
Nedan beskrivs ersättningsmodellen för produkter som marknadsförts mer än ett år genom ett antal räkneexempel.
- Försäljning av produkten uppgår till 1 miljon kronor under ett år. Ersättning = 4,5 miljoner kronor – 1 miljoner kronor = 3,5 miljoner kronor.
- Försäljning av produkten uppgår till 3,9 miljoner kronor under ett år. Ersättning = 4,5 miljoner kronor – 3,9 miljoner kronor = 600 000 kronor.
- Försäljning av produkten uppgår till 4,1 miljoner kronor under ett år. Ersättning = 100 000 miljoner kronor.
- Försäljning av produkten uppgår till 5 miljoner kronor under ett år. Ersättning = 100 000 kronor.
För produkter som har marknadsförts mindre än ett år eller lanseras under avtalsperioden, erhåller företagen en lagerincitamentsdel om 450 000 kronor under denna period oaktat försäljning, det vill säga 10 procent av den maximala ersättningen som tidigare. Detta för att fungera som en extra ”pull-mekanism” för att ett företag ska prioritera Sverige som marknad vid lansering av sitt nya antibiotikum, då det för nya produkter tillkommer extra kostnader för exempelvis registrering. Se figur 1 samt figur 2 för schematiska bilder över ersättningsmodellen.
Figur 1. Visar schematiskt modellen för hur företagen får ersättning för sin försäljning av produkterna till regionerna samt ersättning genom nationella avtal om tillgänglighet, för produkter som marknadsförts < 1 år eller lanseras under avtalsperioden.
Figur 2. Visar schematiskt modellen för hur företagen får ersättning för sin försäljning av produkterna till regionerna samt ersättning genom nationella avtal om tillgänglighet för produkter som marknadsförts > 1 år.
Justeringar för att tydliggöra modellens avsedda produktsegment
Folkhälsomyndigheten har gjort ett antal justeringar av modellen som syftar till att tydliggöra vilket produktsegment som ersättningsmodellen är avsedd för. Det handlar främst om att modellen ska säkra tillgången på den svenska marknaden till antibiotika av särskilt medicinskt värde som är nya eller godkända men ännu inte marknadsförs, det vill säga tidigt i produktlivscykeln. Modellen ska således inte finansiera antibiotikaprodukter eller leverantörer som inte efterfrågas av marknaden där det finns fördelaktigare behandlingsalternativ, men inte heller finansiera antibiotikaprodukter som är ekonomiskt gångbara.
En slutsats av följeforskningen från pilotstudien var att ersättningsmodellen bör uppdateras med en möjlighet att efterhand utesluta eller inte förnya upphandlingen vissa produkter med mycket låg efterfrågan där det tydligt framgått, på grund av låg och icke ökande försäljning under avtalsperioden, att det kliniska behovet inte är tillräckligt stort (8). Mot denna bakgrund har principer införts som gör det möjligt att inte inkludera samt säga upp avtalet för antibiotikaprodukter som marknadsförts på den svenska marknaden i minst två år och där den årliga försäljningen de senaste två åren understiger 450 000 kronor. Justeringen har kompletterats med en skrivning i upphandlingsunderlagen som avser att inte, oavsiktligt, utesluta produkter som haft låg eller ingen försäljning på grund av en långvarig global brist eller liknande.
Förslaget om 450 000 kronor kan härledas till ersättningsmodellen, då det motsvarar 10 procent av den maximala ersättningen. Om ersättningen minus den faktiska försäljningen medför att 90 procent eller mer skulle komma/kommer från ersättningsmodellen så kan alltså produkten komma att uteslutas från modellen. Fördelarna är att det blir tydligt och transparent upphandlingsmässigt, samma för alla och kopplar till ersättningsmodellen. Nackdelarna är att hänsyn inte tas till skillnader i pris eller doser per förpackning.
Som tidigare är en försäljning som inte överskrider 4 miljoner kronor föregående år, ett av kraven för att en produkt ska inkluderas i modellen.
För produkter som uppnår en hög och etablerad försäljning kan inte längre risk för att produkten tas bort från marknaden anses vara överhängande. Tillsammans med justeringen om en lägre försäljningsgräns har modellen kompletteras med en övre försäljningsgräns för att ytterligare tydliggöra vilket segment av nya antibiotikaprodukter som ersättningsmodellen är avsedd för. Vid en årlig försäljning som överstiger 6 miljoner kronor har Folkhälsomyndigheten som beställare rätt att säga upp avtalet i förtid, med 3 månaders varsel.
I pilotstudien och även i denna fortsättning så avser ersättningsmodellen antibiotikaprodukter som är nya på den svenska marknaden och som erhållit centralt marknadsgodkännande (MA) av Europeiska kommissionen 2015 eller senare, eller har ett sannolikt förväntat MA inom kort. Ett tillägg har gjorts inför upphandlingen i detta uppdrag att ingen annan produkt innehållande samma aktiva substans eller substanskombination som produkten i anbudet ska ha erhållit marknadsgodkännande tidigare än 2015. Eftersom marknadsgodkännandet utfärdas på produktnivå, och inte substansnivå, kan det förekomma att produkter som fått ett marknadsgodkännande 2015 eller senare innehåller en äldre läkemedelssubstans, men som börjat marknadsföras på nytt av ett företag. Denna justering tydliggör alltså ytterligare till vilket produktsegment (nya produkter med nya aktiva substanser/substanskombinationer tidigt i produktlivscykeln) just den här ersättningsmodellen riktar sig.
För rekvisitionsantibiotika utan marknadsskydd som är viktiga för sjukvården men har en låg försäljningsvolym föreslog myndigheten i återrapporteringen av ett tidigare uppdrag om tillgänglighet till antibiotika (11) att tillgängligheten bör säkras genom andra åtgärder än en ersättningsmodell. Istället föreslogs att regionerna upphandlar dessa antibiotika med tydliga volymåtaganden eller direkt köp som motsvarar ett antal månaders försäljning som buffert.
Justeringar av krav vid fel
I följeforskningen inom ramen för pilotstudien drogs slutsatsen att ett tillägg om vite eller återbetalning skulle kunna vara lämpligt i en förlängning (8). En sådan lösning har inte utretts inom ramen för detta uppdrag, men föreslås att undersökas i det fortsatta arbetet.
Om företaget inte levererar enligt avtal kan myndigheten enligt nuvarande avtal endast tillämpa en nedsatt ersättning, som maximalt kan utgöra hela ersättningsbeloppet. Det finns dock möjlighet att avsluta avtalet i förtid om företaget inte fullföljer de krav som ställts på tillgänglighet. Nedsättning kan göras vid brister i leverans, bristande lagersaldo eller vid andra fel, och nivåerna för nedsättning i de första två fallen har justerats inför upphandlingen inom uppdraget. Vid andra fel kan ersättningen sättas ned i en omfattning som skäligen motsvarar felet.
För brister i leverans har en lättnad av nedsättningen gjorts sedan tidigare, då det är en procentuell andel av hela årsersättningen som sätts ner och det tidigare kraven bedömdes vara i överkant. Tidigare var den maximalt 2 procent av 4 miljoner kronor, vilket innebar 80 000 kronor per överträdelse, som nu har sänkts till maximalt 0,5 procent som, med den högre ersättningsnivån, blir 22 500 kronor per överträdelse.
För bristande lagersaldo vid rapportering har istället en skärpning av kraven gjorts, där det i tidigare avtal var formulerat så att Folkhälsomyndigheten hade rätt att sätta ned ersättningen med den andel som bristen utgjorde. Detta har nu ändrats till rätten att sätta ned ersättningen ytterligare. Detta bedöms rimligt eftersom vi samtidigt justerat kraven på lagervolymerna, med krav på en lägre lagervolym än tidigare för att motverka onödig kassation, vilket gör det viktigt att företagen tillhandahåller de avtalade lagervolymerna.
Exempel: Om lagersaldot är 8 procent lägre än avtalat vid en kvartalsvis inrapportering, får ersättningen för helåret minskas med 4 procent. Om lagersaldot är 8 procent lägre under samtliga fyra årets kvartal minskas den årliga ersättningen med 16 procent för helåret.
Upphandling av tillgänglighet till medicinskt viktiga antibiotika
Upphandlingen hade flera tilldelade leverantörer utifrån principen om ”fast pris”, där det fasta priset är ersättningen utifrån ersättningsmodellen. Ska-krav för upphandlingen sattes så att produkterna som upphandlas har avsedd effekt och önskad säkerhetsprofil. Specifikationen baserades på de tidigare på krav myndigheten satte upp under pilotstudien (8), avseende aktivitet mot en eller flera av WHO:s ”critical priority pathogens”, det vill säga karbapenemresistenta Enterobacteriaceae, karbapenemresistenta Pseudomonas aeruginosa och karbapenemresistenta Acinetobacter baumanii. Det ställdes även krav på specificerade godkända indikationer samt godkänd säkerhetsprofil.
Det årliga försäljningsvärdet för läkemedlet fick inte överskrida 4 miljoner kronor föregående år och, enligt en av de nya principerna, inte heller understiga 450 000 kronor för antibiotikaprodukter som marknadsförts på den svenska marknaden minst två år.
Utöver kraven ovan ställdes krav på leveranstid och att läkemedelsföretagen tecknar avtal med distributörer och ansvarar för lagerhållning av säkerhetslagret och ägandet av detta, i enlighet med kraven under pilotstudien.
Upphandlingen låg öppen för anbud under perioden 20 juli–6 september 2023. Två av tre produkter i de lämnade anbuden uppfyllde ska-kraven vilket resulterade i tjänstekontrakt med två företag för tillgänglighet och tillhandahållande av två antibiotikaprodukter: Recarbrio (imipenem, cilastatin och relebaktam) och Zavicefta (avibaktam och ceftazidim).
I det fall det finns medel för att fortsätta arbetet med ersättningsmodellen, kommer myndigheten att genomföra en ny upphandling under andra halvan av 2024, med avtalsstart under 2025.
Företagen ska enligt avtalet regelbundet (kvartalsvis och årsvis) skicka rapporter till Folkhälsomyndigheten över lagerstatus och försäljning för de ingående produkterna. Inom detta uppdrag sammanfaller den kvartalsvisa och årliga rapporten till en och samma, vilken används för att validera fakturaunderlagen inför utbetalningarna av ersättningen, i kombination med apotekens försäljningsstatistik från regionerna.
Folkhälsomyndigheten gjorde en utbetalning till företagen som motsvarade perioden från startdatum till den 31 december 2023. Startdatumet var det datum då företagen hade inkommit med dokumentation till Folkhälsomyndigheten att de upprättat ett lager enligt avtalet, och därmed hade rätt till ersättning från staten enligt modellen, vilket var den 6 oktober 2023 för båda företagen.
Vid beräkning av den årliga ersättningen utgår Folkhälsomyndigheten, som tidigare, från den maximala ersättningen och subtraherar sedan summorna från företagens försäljning till regionerna och eventuella fel (beställningar som inte levererades inom 24 timmar eller för liten lagervolym i Sverige).
Antibiotikaprodukter som omfattades av ersättningsmodellen under pilotstudien
Recarbrio ingick även i pilotstudien medan avtal om tillgänglighet till Zavicefta tecknades för första gången i detta uppdrag. Av övriga antibiotikaprodukter som omfattades av pilotstudien så har två av dem en så pass god försäljning att de inte längre kvalificerar för ersättning via ersättningsmodellen, men båda marknadsförs fortsatt och finns tillgängliga på den svenska marknaden. Modellen har således visat sig vara viktig vid en övergångsperiod för att vissa produkter överhuvudtaget ska börja marknadsföras i Sverige och etableras på marknaden.
För de två andra visade det sig att den kliniska efterfrågan var låg efter ett antal år på den svenska marknaden, och med den nya justeringen av modellen kvalificerade inte dessa produkter på nytt för ersättning. För en av dessa lämnades dock ett anbud som således inte uppfyllde ska-kraven i upphandlingen. Den andra produkten tillhandahålls ej för närvarande på den svenska marknaden av det marknadsförande företaget, och gjorde inte heller det vid starten av detta regeringsuppdrag.
Planerade utvärderingar av ersättningsmodellen
Myndigheten planerar att följa upp de förändringar som gjort i ersättningsmodellen jämfört med tidigare. Det handlar om att:
- utvärdera de nya principerna för lagervolym för att säkerställa att de ställda kraven inte leder till risk för bristande tillgänglighet eller fortsatt höga nivåer av kassation
- utvärdera nivån för den garanterade ersättningen inför kommande upphandlingar samt principerna för hur denna beräknas och vid behov utreda om ett annat upplägg skulle vara lämpligt
- utvärdera de nya uppläggen för lagerincitament för att göra en bedömning av om nivåerna reflekterar syftet för de två varianterna
- utvärdera nivån och principerna för låg efterfråganoch vid behov komplettera med mer omfattande analyser, exempelvis se över om efterfrågan ska definieras enligt kliniska mått så som att den aktuella produkten används mindre än 100 behandlingsdygn per år eller liknande
- utvärdera kraven vid fel, och se över om de behöver utvecklas vidare och om ersättningsmodellen bör kompletteras med hårdare krav eller andra sanktioner så somvite eller återbetalning
Förslag till åtgärder
En varaktigt införd ersättningsmodell
Folkhälsomyndigheten föreslår:
- att regeringen, för att få en så effektiv och förutsägbar tillgång till medicinskt viktiga antibiotika, ger Folkhälsomyndigheten i uppdrag att upphandla tillgänglighet till nya antibiotika samt förvalta och utveckla ersättningsmodellen under mer långsiktiga former.
- att Folkhälsomyndigheten aktivt delar Sveriges erfarenheter till andra länder och initiativ, samt beaktar och deltar i den nordiska och europeiska diskussionen, bland annat inom HERA:s arbete med en europeisk ”pull model” för antibiotika samt inom EU-JAMRAI 2 där Sverige (genom Folkhälsomyndigheten) och Norge ska projektleda ett arbetspaket om tillgång till antibiotika.
Pilotstudien visade på behovet av en flexibel modell med möjlighet till nya och uppdaterade upphandlingar eftersom både marknaden, resistensläge och de nationella och internationella kliniska behoven är föränderliga och introduktion av helt nya produkter oftast påverkar marknaden. Myndigheten har börjat forma rutiner och en förvaltning av ersättningsmodellen, men konstaterar samtidigt att en mer permanent och långsiktig process behövs. I arbetet med en mer varaktigt införd ersättningsmodell utgör dock fortsatt utveckling av modellens principer och uppföljning givna element.
Modellen bedöms fortsatt vara ändamålsenlig och effektiv i att säkra tillgänglighet till samt underlätta marknadsetablering av nya antibiotika på den svenska marknaden, och att långsiktighet och förutsägbarhet behövs. Därför borde den etableras varaktigt. Om modellen inte kan införas varaktigt skulle det näst bästa alternativet vara att den förlängs tidsbegränsat via nytt regeringsuppdrag.
Vi anser fortsatt att Folkhälsomyndigheten är den bäst lämpade myndigheten för att upphandla tillgänglighet till nya antibiotika samt förvalta och utveckla ersättningsmodellen under mer permanenta och långsiktiga former.
Förutsatt att det finns medel för att finansiera ersättningen som utgår till företagen vid upphandling av tillgänglighet till nya antibiotika bedömer myndigheten att det fortsatta arbetet med ersättningsmodellen kommer ta personella resurser i anspråk med kompetenser inom projektledning, farmaci, hälsoekonomi, infektionsmedicin, juridik, mikrobiologi och upphandling motsvarande en till två heltidstjänster.
I arbetstiden ingår att kontinuerligt utveckla och följa upp justeringar av ersättningsmodellen, regelbundet initiera nya upphandlingar om tillgänglighet, förvalta och administrera avtal, analysera marknaden, omvärldsbevaka bland annat nationella och internationella kliniska behov samt fortlöpande monitorera det nationella resistensläget. Men också för att föra dialog med intressenter och sprida erfarenheterna av detta arbete både nationellt och internationellt samt återrapportera arbetet i lämpligt format.
Förslag på arbetet framåt samt utvecklingsinsatser
Folkhälsomyndigheten ser ett behov av att följa upp vissa parametrar för att säkerställa en ansvarsfull användning av de nu ingående produkterna, men även de produkter som tidigare ingått i modellen. Exempelvis genom att göra en uppskattning av ungefär hur många patienter som behandlats med de ingående produkterna, bedöma om möjligt vilken patientpopulation som varit aktuell för behandling, samt följa om det finns indikationer på en förändrad användning av de produkter som upphandlats eller jämförbara produkter. Det är viktigt att bevaka försäljningen och påverkan på den övriga antibiotikamarknaden om en ersättningsmodell implementeras mer permanent, så att inte marknaden blir skörare än vad den redan är.
Vidare anser Folkhälsomyndigheten att en utvärdering och återkommande rapportering av ersättningsmodellens ekonomiska konsekvenser bör genomföras för att följa kostnaderna för det offentliga om modellen fortlöper under mer permanenta former.
Folkhälsomyndigheten anser också att det är viktigt med återkommande dialoger med läkemedelsföretag och andra berörda intressenter i det utvärderande arbetet för att ta del av synpunkter och återkoppling så att modellen fortsatt är ändamålsenlig, effektiv samt genomförbar.
Vad gäller kravställningen för miljö så avser Folkhälsomyndigheten att följa upp om modellen ska kompletteras med ytterligare miljökriterier, och exempelvis se över om det kan vara aktuellt att utgå från vissa kriterier som fortsatt ska utvecklas inom ramen för Läkemedelsverkets (LV) och Tandvårds- och läkemedelsförmånsverkets (TLV) uppdrag om att fortsätta att utveckla försöksverksamhet för en miljöpremie inom läkemedelsförmånssystemet som ska slutredovisas senast den 31 mars 2024 (12) (13).
Folkhälsomyndigheten har i detta uppdrag gjort vissa prioriterade utvecklingsinsatser baserat på lärdomar från pilotstudien. Fortsättningen för detta arbete består i att följa upp och utvärdera justeringarna av ersättningsmodellen.
Diskussion
Folkhälsomyndigheten har i detta uppdrag fortsatt att säkerställa tillgång till vissa antibiotika avsedda att användas för svårbehandlade infektioner på sjukhus. Utan tillgång till antibiotika via denna modell riskerar Sverige att inte vara prioriterat för marknadsföring av de senaste läkemedlen då den svenska marknaden utgör en mycket liten marknad globalt.
Myndigheten har utvecklat prioriterade delar av ersättningsmodellen baserat på erfarenheter från en tidigare genomförd pilotstudie (8) och genomfört en upphandling av tillgänglighet där avtal tecknades för två nya antibiotika av särskilt medicinskt värde som uppfyllde ska-kraven.
Även om avtal om tillgänglighet tecknades för färre antibiotikaprodukter än i pilotstudien så har Sverige genom pilotstudien och denna fortsättning säkerställt god tillgång till flera behandlingsalternativ för behandling av svårt sjuka patienter med infektioner orsakade av de specificerade patogenerna. Två produkter som ingick i pilotstudien, men inte inkluderades i upphandlingen denna gång, är etablerade på den svenska marknaden tack vara pilotstudien och har en god försäljning som gör att de inte längre kvalificerar till denna ersättningsmodell.
Modellen bedöms fortsatt vara ändamålsenlig och effektiv i att säkra tillgänglighet till samt underlätta marknadsetablering av nya antibiotika på den svenska marknaden och dess användningsområde har även utvidgats.
Ersättningsmodellen för nya antibiotika av särskilt medicinskt värde är nu en av utgångspunkterna i myndighetens uppdrag att genomföra en förstudie om en ny ersättningsmodell för att tillhandahålla ett buffertlager av vissa antibiotikaprodukter (S2023/02106 (delvis)) (9) vilket visar att vissa av dessa principer även kan appliceras på äldre antibiotikaprodukter i andra änden av produktlivscykeln.
Det finns ett fortsatt stort internationellt intresse för ersättningsmodellen och bland annat Kanada har inspirerats och tagit lärdom av Sveriges erfarenheter från pilotstudien och fortsatta arbete då de nu tar fram en ersättningsmodell anpassad för den kanadensiska kontexten. Det är av stor vikt att myndigheten fortsatt aktivt deltar och sprider erfarenheterna från arbetet i en internationell kontext, inklusive på en nordisk och europeisk nivå inom de närliggande initiativ som pågår.
Resistensutveckling hos bakterier sker hela tiden och marknadsgodkännande av nya antibiotikaprodukter sker också fortlöpande varför en kontinuerlig justering och utvärdering av en sådan här ersättningsmodell behövs. Samtidigt behövs långsiktighet och förutsägbarhet.
Utifrån uppdraget i detta regeringsuppdrag att fortsatt öka tillgängligheten till vissa antibiotika föreslår vi därför att regeringen ger Folkhälsomyndigheten i uppdrag att upphandla tillgänglighet till nya antibiotika genom att varaktigt införa denna ersättningsmodell med därtill hörande finansiering från staten. Myndigheten har tidigare visat att modellen säkrar svensk tillgång till nya antibiotika genom att erbjuda ett ekonomiskt incitament riktat till nya produkter under den tidiga delen av deras marknadsintroduktion. Ersättningsmodellen ska ses som en av flera åtgärder i strävan mot en hållbar tillgång till effektiva antibiotika längs hela kedjan i en så kallad ”end-to-end approach”. I relation till detta är stewardship-program, infektionsprevention och diagnostik avgörande för att behålla livslängden på de antibiotika vi har och förebygga infektioner.
Referenser
- Folkhälsomyndigheten och Jordbruksverket. Tvärsektoriell handlingsplan mot antibiotikaresistens 2021–2024 – Underlag för samverkansgruppens fortsatta arbete [Internet]. Solna: Folkhälsomyndigheten; 2021. [citerad 23-10-16]. Hämtad från: https://www.folkhalsomyndigheten.se/publikationer-och-material/publikationsarkiv/t/tvarsektoriell-handlingsplan-mot-antibiotikaresistens-20212024/
- Regeringskansliet. Regeringens nationella strategi för arbetet mot antibiotikaresistens 2024-2025 [Internet]. Stockholm; Socialdepartementet; 2023. [citerad 23-10-16]. Hämtad från: https://www.regeringen.se/contentassets/6af6006cac97425180a8d86d5242d510/svensk-strategi-for-arbetet-mot-antibiotikaresistens-ny.pdf
- Europeiska kommissionen. A European One Health Action Plan against Antimicrobial Resistance (AMR) [Internet]. Bryssel; Europeiska kommissionen; 2017. [citerad 23-10-16]. Hämtad från: https://health.ec.europa.eu/system/files/2020-01/amr_2017_action-plan_0.pdf
- Directorate-General for Health and Food Safety. Council Recommendation on stepping up EU actions to combat antimicrobial resistance in a One Health approach [Internet]. Bryssel; Europeiska kommissionen; 2023. [citerad 23-10-16]. Hämtad från: https://health.ec.europa.eu/publications/council-recommendation-stepping-eu-actions-combat-antimicrobial-resistance-one-health-approach_en?prefLang=sv
- Europeiska kommissionen. Reform of the EU pharmaceutical legislation [Internet]. Bryssel: Europeiska kommissionen; 2023. [citerad 23-10-16]. Hämtad från: https://health.ec.europa.eu/medicinal-products/pharmaceutical-strategy-europe/reform-eu-pharmaceutical-legislation_en?prefLang=sv
- Regeringskansliet. Nationell läkemedelsstrategi 2024–2026 [Internet]. Stockholm; Socialdepartementet; 2024. [citerad 24-02-08]. Hämtad från: https://www.regeringen.se/contentassets/7fffd4ff497147b38bf242914080cfec/lakemedelsstrategin-final.pdf
- M., Panteli D., och Mossialos E.. How can the EU support sustainable innovation and access to effective antibiotics? Policy options for existing and new medicines [Internet]. Köpenhamn: European Observatory on Health Systems and Policies; 2023; 51. [citerad 2023-10-17]. Hämtad från: https://www.ncbi.nlm.nih.gov/books/NBK594073/
- Folkhälsomyndigheten. Tillgänglighet till vissa antibiotika – Slutrapport från en pilotstudie av en alternativ ersättningsmodell [Internet]. Solna: Folkhälsomyndigheten; 2023. [uppdaterad 2023-05-31; citerad 2023-10-17] Hämtad från: https://www.folkhalsomyndigheten.se/publikationer-och-material/publikationsarkiv/t/tillganglighet-till-vissa-antibiotika-slutrapport-fran-en-pilotstudie-av-en-alternativ-ersattningsmodell/
- Regeringskansliet. Uppdrag att genomföra en förstudie om en ny ersättningsmodell för att tillhandahålla ett buffertlager av vissa antibiotikaprodukter [Internet]. Stockholm: Socialdepartementet; 2023 [uppdaterad 2023-08-08; citerad 2023-10-20]. Hämtad från: https://www.regeringen.se/regeringsuppdrag/2023/08/uppdrag-att-genomfora-en-forstudie-om-en-ny-ersattningsmodell-for-att-tillhandahalla-ett-buffertlager-av-vissa-antibiotikaprodukter/
- Folkhälsomyndigheten. Definiera och värdera antibiotika med tillgänglighetsproblem
- Delrapport 1 i regeringsuppdrag om Tillgänglighet till antibiotika [Internet]. Solna: Folkhälsomyndigheten; 2017. [uppdaterad 2018-01-10; citerad 2023-10-17] Hämtad från: https://www.folkhalsomyndigheten.se/publikationer-och-material/publikationsarkiv/t/tillganglighet-till-antibiotika/ - Folkhälsomyndigheten. Modeller för lagerhållning och distributionsvägar - Delrapport 3 i regeringsuppdrag om Tillgänglighet till antibiotika [Internet]. Solna: Folkhälsomyndigheten; 2017. [uppdaterad 2018-01-10; citerad 2023-10-17] Hämtad från: https://www.folkhalsomyndigheten.se/publikationer-och-material/publikationsarkiv/t/tillganglighet-till-antibiotika/
- Läkemedelsverket. Läkemedelsverkets uppdrag [Internet]. Uppsala; Läkemedelsverket; 2019 [uppdaterad 2023-12-29; citerad 2023-10-20]. Hämtad från: https://www.lakemedelsverket.se/sv/om-lakemedelsverket/uppdrag#hmainbody1
- Tandvårds- och läkemedelsförmånsverket. Regeringsuppdrag, Fortsätta utveckla försöksverksamhet för en miljöpremie i läkemedelsförmånssystemet [Internet]. Stockholm; Tandvårds- och läkemedelsförmånsverket; 2023 [uppdaterad 2024-02-06; citerad 2023-10-20]. Hämtad från: https://www.tlv.se/om-tlv/regeringsuppdrag.html
