
En förstudie om en ny ersättningsmodell för att tillhandahålla ett buffertlager av vissa antibiotikaprodukter
Sammanfattning
Folkhälsomyndigheten har fått i uppdrag av regeringen att genomföra en förstudie av en ersättningsmodell för att säkerställa tillgängligheten till ett buffertlager av prioriterade äldre antibiotika.
Äldre antibiotika med risk för bristande tillgänglighet har valts ut
Folkhälsomyndigheten har gjort ett urval av äldre antibiotikaprodukter. Urvalet har gjorts genom att följa en arbetsgång baserad på en prioriteringslista över medicinskt viktiga antibiotika med risk för bristande tillgänglighet som myndigheten tagit fram tidigare. Från denna lista har ett antal avgränsningar gjorts, där bland annat äldre antibiotika som rekommenderas som förstahandsval och inte är utbytbara har prioriterats.
Modellen ger företagen ekonomiska incitament att behålla produkterna på marknaden
Inom ramen för förstudien föreslår Folkhälsomyndigheten en modell för att upphandla tillgänglighet till ett omsättningsbart centralt buffertlager av äldre antibiotikaprodukter. Modellen innebär att läkemedelsföretagen erbjuds ersättning, villkorad av att de kvartalsvis ska visa att de håller ett buffertlager hos distributör motsvarande sex månaders normalförbrukning av en specifik produkt.
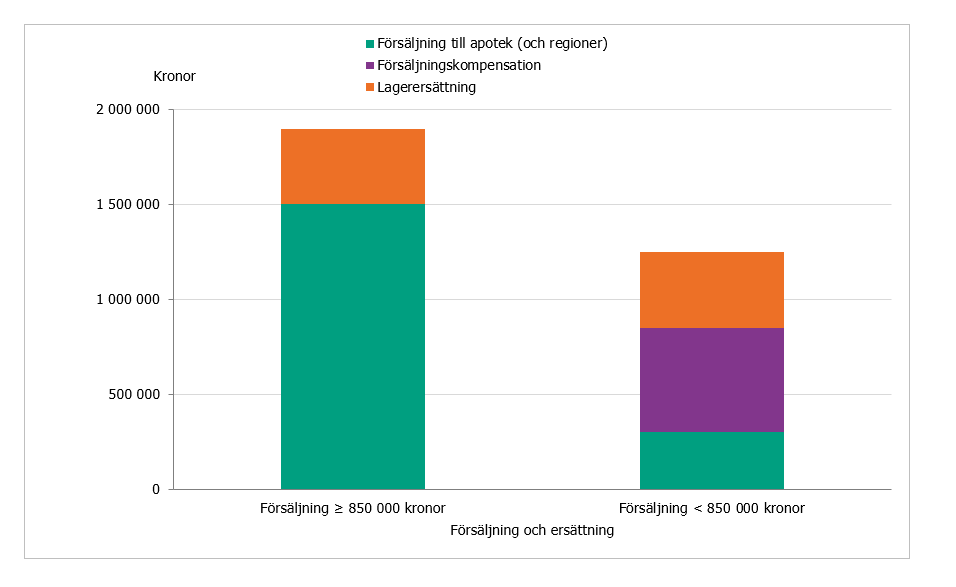
Modellen är utformad för att ge företagen ekonomiska incitament att fortsätta tillhandahålla produkterna på den svenska marknaden. Myndigheten föreslår en årlig lagerersättning på 400 000 kronor per produkt definierat som substans, beredningsform och styrka. För produkter med en årlig försäljning understigande 850 000 kronor, erbjuds ytterligare försäljningskompensation upp till denna summa.
Den föreslagna modellen innebär en årlig kostnad om cirka 17 miljoner kronor för att upphandla tillgänglighet till ett buffertlager om sex månader av 20 prioriterade förstahandsalternativ vid vanliga infektioner med risk för bristande tillgänglighet på den svenska marknaden, som valts ut genom urvalsprocessen framtagen i förstudien. I denna summa ingår även kostnader för Folkhälsomyndigheten för det fortsatta arbetet.
Pilotstudie rekommenderas för att testa och implementera modellen
Som ett resultat av denna förstudie rekommenderar Folkhälsomyndigheten att ersättningsmodellen som har utretts testas och implementeras i en pilotstudie. Regeringen föreslås ge Folkhälsomyndigheten i uppdrag att testa och implementera ersättningsmodellen i en pilotstudie, och att medel tillskjuts för att upphandla tillgänglighet till ett buffertlager samt bekosta Folkhälsomyndighetens fortsatta arbete.
Förutsättningar för nordisk samverkan
Folkhälsomyndigheten har genom förstudien identifierat flera områden för att stärka förutsättningarna som kan bidra till en ökad tillgänglighet till prioriterade äldre antibiotikaprodukter i de nordiska länderna och ser vikten av att fortsatt följa och dela erfarenheter på nordisk nivå.
Summary
The Public Health Agency of Sweden has been commissioned by the government to carry out a preliminary study of a reimbursement model to ensure the availability of a buffer stock of prioritised off-patent antibiotics.
Off-patent antibiotics at risk of insufficient availability have been selected
The Public Health Agency of Sweden has identified prioritised off-patent antibiotics that were selected through a proposed methodology. The methodology for selection is based on a priority list of medically important antibiotics with a risk of insufficient availability that the agency previously published. From this list, a number of delineations were made, where, for example, older antibiotics that are recommended as first line treatment and are not interchangeable were prioritised.
The model gives pharmaceutical companies financial incentives to keep the products on the market
The agency proposes a model for procuring availability to a central buffer stock of older antibiotic products. According to this model, a compensation is offered to the pharmaceutical companies, on condition that they demonstrate quarterly that they keep a buffer stock at the distributor corresponding to 6 months' normal consumption for the specific antibiotic product.
The model is designed to give companies financial incentives to continue providing the products on the Swedish market. The agency proposes an annual inventory compensation of SEK 400,000 per product, defined as substance, form of preparation and strength. For products with annual sales of less than SEK 850,000, an additional sales compensation is offered up to this amount.
The proposed model involves an annual cost of approximately SEK 17 million to procure the availability of a buffer stock in 6 months from 20 prioritised first-line options for common infections with a risk of lack of availability on the Swedish market, which were selected through the process developed in the preliminary study. This sum also includes personnel resources at the agency for administration and management.
Pilot study is recommended to test and implement the model
As a result of this preliminary study, the Public Health Agency of Sweden (recommends) that the reimbursement model we have investigated in this preliminary study should be tested and implemented in a pilot study. We therefore propose that the government commission the Public Health Agency of Sweden to test and implement the reimbursement model in a pilot study and finance the procurement of availability to a buffer stock and the continued work at the agency.
Conditions for Nordic cooperation
Through the preliminary study, the Public Health Agency of Sweden has identified several areas where conditions could be strengthened to allow for a potential increased availability of prioritised older antibiotic products in the Nordic countries. The agency sees the importance of continuing to follow and share experiences at the Nordic level.
Om publikationen
Denna rapport baseras på Folkhälsomyndighetens slutrapportering av regeringsuppdraget Att genomföra en förstudie om en ny ersättningsmodell för att tillhandahålla ett buffertlager av vissa antibiotikaprodukter (S2023/02106 (delvis)).
Många av de äldre antibiotikaprodukterna som säljs på recept är olönsamma för läkemedelsföretagen och riskerar försvinna eller vara restnoterade långa perioder. I denna slutrapportering beskrivs myndighetens förslag på kriterier och riktlinjer för en ersättningsmodell för att stärka tillgängligheten till ett prioriterat urval av äldre antibiotikaprodukter, samt ett förslag på en urvalsprocess. Arbetet bygger på Folkhälsomyndighetens tidigare uppdrag om Att stärka tillgången till äldre antibiotika (S2021/06172).
Modellen är utformad för att ge läkemedelsföretag ekonomiska incitament att fortsätta tillhandahålla produkterna på den svenska marknaden för att förhindra att patienter och sjukvården står utan prioriterade äldre antibiotikaprodukter på grund av korta och medellånga bristsituationer eller för att företagen slutar att marknadsföra produkten på grund av främst dålig lönsamhet.
Rapporten beskriver ekonomiska konsekvenser av den föreslagna modellen och ett förslag om fortsatt arbete.
Folkhälsomyndigheten
Agneta Falk Filipsson
Tillförordnad avdelningschef, Avdelningen för smittskydd och hälsoskydd
Ordlista
Aktiv substans – det ämne i ett läkemedel som ger det dess medicinska effekt.
Beredningsform – olika former för hur ett läkemedel kan tillföras kroppen, till exempel via tablett, injektionsvätska eller plåster. Även kallad form.
Bristsituation – en restsituation av ett läkemedel som inte är utbytbart.
Form – se beredningsform.
Generiskt läkemedel – läkemedel som innehåller samma aktiva substans, i samma beredningsform och med samma styrka, och som ger samma medicinska effekt.
Läkemedelsförmån – ett läkemedel som ingår i läkemedelsförmånerna är subventionerat och ingår i högkostnadsskyddet vilket begränsar hur mycket en kund behöver betala för sina läkemedel. Även kallat förmånerna.
Marknadslivscykel – avser i denna rapport tiden från en läkemedelsprodukt erhållit marknadsgodkännande tills att den avregistreras och/eller slutar tillhandahållas på en marknad.
Marknadsskydd - Om en produkt har marknadsskydd är det inte tillåtet för andra företag att börja sälja en motsvarande generisk produkt. Denna period är oftast 10 år efter ett nationellt eller centralt marknadsgodkännande.
Originalläkemedel – det första läkemedlet på marknaden som innehåller en viss aktiv substans. Dessa läkemedel har patentskydd och blir därmed inte föremål för konkurrens från generiska motsvarigheter under ett antal år.
Parallellimporterade läkemedel – Med parallellimport avses import till Sverige från ett land inom europeiska ekonomiska samarbetsområdet (EES) av ett läkemedel som är godkänt för försäljning i Sverige och i exportlandet, men importen sköts av annan än tillverkaren/innehavaren av godkännandet för försäljning.
Periodens vara – den läkemedelsförpackning som är tillgänglig, har lägst pris inom varje utbytesgrupp och förpackningsstorleksgrupp och som apoteken ska erbjuda sina kunder. Periodens vara utses av TLV.
Produkt – avser i denna rapport ett antibiotika med en viss aktiv substans eller substanskombination, beredningsform och styrka.
Pull-incitament – Ekonomiskt incitament för att ge de företag som sätter en ny produkt på marknaden en ersättning som är helt eller delvis frikopplad från den framtida försäljningsvolymen.
Push-mekanismer – syftar till att stimulera forskning och utveckling, och ska underlätta arbetet med att få fram nya läkemedelskandidater som kan utgöra grunden för fortsatt läkemedelsforskning.
Regioner – det som fram till 2019 kallades för landsting.
Slutenvård – vård som bedrivs då patienten ligger på sjukhus.
Stewardship - Samordnade insatser med avsikt att mäta och förbättra ändamålsenlig användning av antibiotika genom optimal antibiotikabehandling inklusive dosering, behandlingstidens längd och administreringsväg.
Subvention – den del av kostnaden för ett läkemedel, en tandvårdsåtgärd eller en förbrukningsartikel som staten betalar
Sykehusapotekene HF – norskt statligt hälsoföretag (HF) som bland annat äger sjukhusapotek
Takpriser i utbytesgrupper – det högsta accepterade priset (AIP/enhet) på ett läkemedel i en förpackningsstorleksgrupp.
Utbytesgrupp – är en grupp av läkemedel som enligt Läkemedelsverkets lista över utbytbara läkemedel är sinsemellan utbytbara.
Utbytbara läkemedel – läkemedel som Läkemedelsverket har bedömt är utbytbara med varandra eftersom de innehåller samma aktiva substans, i samma beredningsform och med samma styrka och de ger samma medicinska effekt.
Äldre antibiotika – antibiotika där marknadsexklusiviteten gått ut (normalt minst 10 år sen första registrering) och där flertal utbytbara generikaprodukter kan förekomma.
Öppenvård – vård som främst bedrivs som primärvård via vårdcentraler och vid specialistmottagningar.
Öppenvårdsantibiotika – antibiotika som används inom öppenvården, vilket ofta innebär att de har förskrivits på recept och expedieras på öppenvårdsapotek.
Förkortningar
AIP – apotekens inköpspris. Motsvarar läkemedelsföretagens försäljningspris inkl. kostnad för distribution.
AMR – antimikrobiell resistens. I det här arbetet avses främst antibiotikaresistens hos bakterier.
EU-JAMRAI 2 – European Union Joint Action on Antimicrobial Resistance and Healthcare-Associated Infections 2
FGL – Föreningen för generiska läkemedel och biosimilarer
FHI – Folkehelseinstituttet (Norges folhälsomyndighet)
HERA – Europeiska myndigheten för beredskap och insatser vid hälsokriser (Health Emergency Preparedness and Response Authority)
LIF – Läkemedelsindustriföreningen
LOU – Lag (2016:1145) om offentlig upphandling
LV – Läkemedelsverket
MAH – innehavare av marknadsföringstillstånd (Market Authorisation Holder).
PLATINEA – PLATform for INnovation of Existing Antibiotics
SKR – Sveriges Kommuner och Regioner
SOU – Statens offentliga utredningar
TLV – Tandvårds- och läkemedelsförmånsverket
WHO – Världshälsoorganisationen (World Health Organization)
Bakgrund
Antimikrobiell resistens (AMR) medför ökade kostnader för samhället och har negativa följder för arbetet med hållbar utveckling världen över. Världshälsoorganisationen (WHO) ser antibiotikaresistens som ett av de största av alla globala hälsohot. Sverige har ett jämförelsevis gott resistensläge, bland annat tack vare ett långvarigt aktivt engagemang av flera nationella och lokala aktörer, bland annat genom myndighetssamverkan och lokala Stramagrupper. All användning av antibiotika driver resistensutvecklingen och det är därför av största vikt att antibiotika endast används när det behövs och så ansvarsfullt som möjligt.
Ett brett, och tillgängligt, sortiment av antibiotika är en förutsättning för att bedriva en modern sjukvård och bromsa utvecklingen av resistenta bakterier. Äldre antibiotikaprodukter som sedan länge förlorat sitt marknadsskydd är ofta kommersiellt oattraktiva. Detta gäller inte minst produkter med låg försäljning i låga volymer såsom formuleringar avsedda för barn samt smalspektrumantibiotika, vilka främst efterfrågas i länder med låg antibiotikaresistens.
Det finns en stor risk för bristande tillgänglighet till antibiotika, med återkommande problem med rest- och bristsituationer i Sverige och globalt. Vidare finns en risk för avregistreringar. I Sverige är läkemedelsgruppen J01, antibakteriella medel för systemiskt bruk, den grupp av läkemedel som är på tredje plats avseende restsituationer under 2023 (1).
Det behövs åtgärder för att stärka tillgängligheten och ta höjd för rest- och bristsituationer samt förhindra avregistrering för de äldre antibiotikaprodukter med stor risk för bristande tillgänglighet som identifieras få de största kliniska konsekvenserna om de inte finns tillgängliga.
Vid brist på rekommenderade förstahandspreparat finns det risk för att alternativ skrivs ut som är dyrare, har fler negativa bieffekter eller är sämre ur resistenssynpunkt. Det är därför viktigt att säkerställa tillgången till rekommenderade förstahandspreparat, vilket ofta är äldre antibiotika.
Insatser för ökad tillgång till antibiotika är en viktig del i arbetet mot antibiotikaresistens, och finns med i flera styrdokument på området så som den myndighetsgemensamma handlingsplanen mot antibiotikaresistens 2021– 2024 som tagits fram av den nationella samverkansfunktionen (2), regeringens nationella strategi för arbetet mot antibiotikaresistens (3), Europeiska kommissionens sektoröverskridande handlingsplan mot antibiotikaresistens (4), Europeiska kommissionens rådsrekommendationer om intensifiering av EU:s åtgärder för att bekämpa antimikrobiell resistens genom en One health-modell (5), Europeiska kommissionens förslag på ny förordning och nytt direktiv för reform av EU:s läkemedelslagstiftning som presenterades i april 2023 (6), och den nyligen beslutade nationella läkemedelsstrategin med fokus på bland annat förbättrad tillgänglighet till nya och gamla läkemedel, där antibiotika lyfts fram som särskilt viktiga i sammanhanget (7).
Under det svenska EU-ordförandeskapet arrangerades ett högnivåmöte den 6-7 mars 2023 om antibiotikaresistens. Det rådde enighet om att det inte är en enstaka åtgärd som löser problemenen med forskning och utveckling av nya antibiotika, samt tillgången på nya och gamla antibiotika. Istället behövs en kombination av incitament för både ”push” och ”pull” som säkerställer hela kedjan i en ”end-to-end approach”, från grundforskning, via kliniska prövningar, till marknadsgodkännande och tillverkning och distribution, där ersättningsmodeller för nya och äldre kliniskt prioriterade antibiotika är en viktig del (8). Olika åtgärder för att säkra tillgång till antibiotika behövs och bör anpassas efter förutsättningarna för produkten i olika delar av marknadslivscykeln.
Uppdraget
Regeringen gav i juni 2023 Folkhälsomyndigheten i uppdrag att genomföra en förstudie om en ny ersättningsmodell, där läkemedelsföretag får ersättning för att tillhandahålla ett definierat buffertlager av prioriterade äldre antibiotika på den svenska marknaden.
Under förstudien skulle Folkhälsomyndigheten enligt uppdraget utveckla kriterierna och riktlinjerna för en sådan ersättningsmodell, vilket bland annat innefattade att
- ta fram förslag på en process för urval av antibiotikaprodukter
- göra ett urval av prioriterade äldre antibiotikaprodukter baserat på urvalsprocessen
- slå fast en ersättningsnivå för de ingående produkterna
- identifiera krav på de ingående företagen för medverkan
Myndigheten skulle också utreda möjligheten till eventuellt samarbete eller samordning med övriga nordiska länder om en ersättningsmodell för äldre antibiotika.
Folkhälsomyndigheten skulle i arbetet utgå från det förslag som myndigheten lämnade i sin slutredovisning av det tidigare uppdraget om att stärka tillgången till äldre antibiotika – kartläggning och förslag på åtgärder (S2021/06172) (9) som utfördes tillsammans med Tandvårds- och läkemedelsförmånsverket (TLV) och Läkemedelsverket, och redovisades till Regeringskansliet den 11 november 2022. Därtill borde myndigheten enligt uppdraget ta vara på erfarenheter och lärdomar från pilotstudien av tillgänglighet till vissa nya antibiotika (S2018/03920) (10), som slutrapporterades 31 maj 2023 och ett fortsatt uppdrag där ersättningsmodellen justerats inför en upphandling som gjordes inom ramen för det uppdraget (S2023/01709 (delvis)) (11), som pågått parallellt med detta uppdrag.
Syfte
Det övergripande syftet med uppdraget är att stärka tillgängligheten till prioriterade äldre antibiotika på den svenska marknaden på kort och medellång sikt, så att patienterna och den svenska hälso- och sjukvården har tillgång till de mest ändamålsenliga behandlingsalternativen. Syftet är också att ge ett särskilt ekonomiskt incitament till företag att behålla dessa produkter på den svenska marknaden så att de inte avregistreras.
Metod
Projektorganisation
För arbetet med uppdraget tillsatte Folkhälsomyndigheten en intern projektgrupp med kompetens inom farmaci, infektionsmedicin, juridik, mikrobiologi och upphandling.
Genomförande
Folkhälsomyndigheten har i denna förstudie utvecklat principer för den modell som föreslogs i det föregående uppdraget (S2018/03920) (9) avseende process för urval och prioritering av äldre antibiotikaprodukter, ersättningsnivå och upphandlingskrav. Folkhälsomyndigheten har föreslagit principer som syftar till att minimera påverkan på den befintliga marknaden, utrett ekonomiska konsekvenser av den föreslagna modellen samt utrett de juridiska förutsättningarna för att implementera den föreslagna modellen i en pilotstudie.
Dialog med externa parter
I utredningen har Folkhälsomyndigheten fört dialog med TLV om bland annat deras regeringsuppdrag om att utreda frågor om omsättningslagring av vissa läkemedel i syfte att säkerställa en god försörjningsberedskap (12).
Vi har diskuterat beröringspunkter med TLV avseende deras två pågående uppdrag om en fördjupad analys av takprissystemet avseende reglering av antibiotika (13) samt om att fortsätta utveckla försöksverksamhet för en miljöpremie i läkemedelsförmånssystemet (14). Folkhälsomyndigheten har även fört dialog med Läkemedelsverket och diskuterat beröringspunkter mellan detta uppdrag och deras närliggande uppdrag och arbeten (15), till exempel deras uppdrag att förebygga och hantera rest- och bristsituationer avseende läkemedel (16) samt tagit del av aktuell statistik från Läkemedelsverket om restsituationer på antibiotikaområdet. Under utredningen har myndigheten skickat frågor till läkemedelsföretag och branschföreningarna Läkemedelsindustriföreningen (LIF) och Föreningen för generiska läkemedel och biosimilarer (FGL). Detta för att få ta del av företagens och branschens perspektiv och synpunkter på vilka incitament som krävs för att de, enligt egen redogörelse, ska kunna tillhandahålla ett buffertlager av äldre antibiotika och behålla produkterna på den svenska marknaden.
Dessutom har vi haft ett möte med representanter från Norge (Sjukhusapoteka Vest, Folkehelseinstituttet (FHI), Norska hälsodepartementet, Statens legemiddelverk, Sykehusinnkjöp och Sykehusapotekene HF) som byggt upp ett norskt beredskapslager (Beredskapslagring B180) av läkemedel (17), för att bland annat diskutera hur de hanterat urvalskriterier och andra aspekter i sitt arbete. Vi har även skickat frågor till representanter för Norge, Danmark och Finland om möjligheter och utmaningar för samarbete och samverkan om tillgång till antibiotika, för att få flera nordiska länders perspektiv på dessa frågor och identifiera gemensamma lämpliga vägar framåt.
Andra relaterade uppdrag
Myndigheten har även tagit del av andra relaterade uppdrag och initiativ på området, exempelvis Socialstyrelsens uppdrag att ta fram underlag för vilka sjukvårdsprodukter som bör omfattas av hälso- och sjukvårdens försörjningsberedskap (18). Vi har också tagit del av Regeringens och Sveriges Kommuner och Regioners (SKR) överenskommelse från sommaren 2023 om att bygga upp försörjningsberedskapen för slutenvårdsläkemedel och medicintekniska produkter (19), för att sätta denna ersättningsmodell i en större kontext i relation till andra pågående arbeten som kan påverka tillgängligheten till läkemedel.
Myndigheten har också tagit del av SOU 2021:19 En stärkt försörjningsberedskap för hälso- och sjukvården (20) vad gäller de delar som omfattar vardagsförsörjning.
Avgränsningar
Uppdraget avser vardagsförsörjning och avgränsas till äldre antibiotika avsedda för humant bruk. Med äldre antibiotika avses substanser och substanskombinationer som saknar marknadsskydd vilket oftast motsvarar att de varit godkända minst 10 år.
Folkhälsomyndighetens förslag på ersättningsmodell
Inom Folkhälsomyndighetens tidigare uppdrag om att stärka tillgången till äldre antibiotika (S2021/06172) (9) arbetades vissa kriterier och riktlinjer för en ny ersättningsmodell fram som legat till grund för arbetet inom detta uppdrag.). Det föreslagna buffertlagret är tänkt att hållas i den normala distributionskedjan, och läkemedelsföretag ska ha möjlighet att få ersättning för lagerhållning hos distributör. Grunden i modellen är att tillgängligheten till de prioriterade äldre antibiotikaprodukterna ska upphandlas till ett omsättningsbart nationellt buffertlager.
Process för urval av äldre antibiotikaprodukter
Den föreslagna arbetsgången för urval av antibiotikaprodukter som ska ingå i den nya modellen utgår från myndighetens prioriteringslista över antibiotika som riskerar eller har otillräcklig tillgänglighet. Den senaste versionen av listan togs fram inom det tidigare regeringsuppdraget om att stärka tillgången till äldre antibiotika (S2021/06172) (9) i samverkan med samverkansplattformen PLATINEA och en extern referensgrupp med kliniska experter.
Prioriteringslistan togs fram genom att ett urval gjordes av de antibiotikaprodukter som bedömdes ha risk för bristande tillgänglighet baserat på ett antal parametrar såsom låg försäljning och upprepade bristsituationer. Experterna i referensgruppen gjorde sedan en klinisk värdering av antibiotikaprodukterna utifrån deras substans, beredningsform och styrka och poängsatte samtliga produkter på skalan 0–2. Produkternas poäng sammanställdes och kategoriserades av Folkhälsomyndigheten i tre kategorier, A, B och C.
Urvalet av äldre antibiotikaprodukter inom det nuvarande uppdraget utgår från prioriteringslistan som beskrivs ovan. Därtill föreslås att följande avgränsningar görs för att ytterligare begränsa urvalet:
- A- och B-produkter (substans/beredningsform/styrka) enligt den tidigare framtagna prioriteringslistan för äldre antibiotika som riskerar eller har otillräcklig tillgänglighet på grund av låg lönsamhet. Dessa kategoriserades enligt följande:
- A. Mycket värdefull att ha tillgång till i Sverige. Påtagliga kliniska konsekvenser om produkten inte är tillgänglig.
- B. Värdefull att ha tillgång till i Sverige. Kliniska och/eller logistiska (resursmässiga) konsekvenser om produkten inte är tillgänglig.
- Endast perorala produkter som rekommenderas som förstahandsval för behandling av vanliga infektioner i öppenvården, inklusive tuberkulos (enligt nationella behandlingsrekommendationer). Det är angeläget att ha tillgång till förstahandsval för att minska risken för både onödiga biverkningar och ökad resistensutveckling, vilket även lyfts i beskrivningen av det nuvarande uppdraget. Tuberkulos är en mycket smittsam sjukdom som kan medföra allvarliga konsekvenser för samhället om inte adekvat behandling finns tillgänglig. Den stora majoriteten av äldre antibiotika är sådana som hämtas ut på apotek.
- Endast produkter som inte ingår i periodens vara-systemet. Periodens varor är de generiskt utbytbara läkemedel som har lägst pris och som apoteken erbjuder sina kunder när de byter ut läkemedel.
- Endast produkter som inte är utbytbara enligt Läkemedelsverkets bedömning. Undantag kan göras om produkten enbart är utbytbar mot en parallellimporterad vara. Produkter som inte är utbytbara bedöms vara mycket sårbara vid restsituationer och även vid avregistrering eftersom inget likvärdigt alternativ finns att tillgå. I de fall det finns flera produkter med samma substans, beredningsform och styrka som inte är utbytbara, kan andra urvalsprinciper behöva tillämpas, vilket bör utredas i ett senare skede.
Urval av prioriterade äldre antibiotikaprodukter
Ett urval baserat på den föreslagna processen och avgränsningarna ovan resulterade i december 2023 i 20 produkter (definierat som substans, beredningsform och styrka). Det vi i kallar flytande antibiotikaberedningar tillhandahålls som regel egentligen i beredningsformerna pulver eller granulat till oral lösning eller oral suspension. Den flytande beredningen iordningställs av farmaceuter eller sjukvårdspersonal på apotek eller sjukhus inför användandet. Urvalet presenteras i tabell 1 nedan.
Några av egenskaperna för dessa produkter är följande:
- Samtliga hade låg försäljning 2022 (från cirka 100 000 kronor till cirka 2,4 miljoner kronor).
- 16 är främst pediatriska formuleringar, alltså formuleringar avsedda för barn.
- 17 hade minst en restsituation under åren 2018–2023, varav 16 av dessa i minst tre månader. En restsituation uppstår när läkemedelsföretag inte kan leverera läkemedel så att tillgång möter efterfrågan.
- Mediantiden för restsituationer för dessa 17 är över 70 dagar.
- 16 bedöms som inte utbytbara enligt Läkemedelsverket (oktober 2023).
- 4 har 1–2 parallellimporter.
- 2 har samma substans, beredningsform och styrka men olika smak och bedöms inte vara utbytbara enligt Läkemedelsverket.
- 5 produkter är avsedda för att behandla tuberkulos.
| Substans | Beredningsform | Styrka |
|---|---|---|
| Amoxicillin | Flytande | 50 mg/ml |
| Amoxicillin | Flytande | 100 mg/ml |
| Amoxicillin-klavulansyra | Flytande | 50 mg/ml + 13 mg/ml |
| Amoxicillin-klavulansyra | Flytande | 80 mg/ml + 12 mg/ml |
| Ciprofloxacin | Flytande | 50 mg/ml |
| Ciprofloxacin | Flytande | 100 mg/ml |
| Doxycyklin | Flytande | 10 mg/ml |
| Erytromycin | Flytande | 100 mg/ml |
| Erytromycin | Tablett/kapsel | 250 mg |
| Fenoximetylpenicillin | Tablett/kapsel | 250 mg |
| Fenoximetylpenicillin | Tablett/kapsel | 500 mg |
| Flukloxacillin | Tablett/kapsel | 125 mg |
| Klindamycin | Flytande | 15 mg/ml |
| Rifabutin | Tablett/kapsel | 150 mg |
| Rifampicin | Flytande | 20 mg/ml |
| Rifampicin | Tablett/kapsel | 150 mg |
| Rifampicin och isoniazid | Tablett/kapsel | 150 mg/75 mg |
| Rifampicin, pyrazinamid, etambutol och isoniazid | Tablett/kapsel | 150 mg/75 mg/400 mg/275 mg |
| Trimetoprim-sulfametoxazol | Flytande | 40 mg/ml + 8 mg/ml |
Synpunkter från läkemedelsföretag och branschföreningarna LIF och FGL
Folkhälsomyndigheten har inhämtat synpunkter från läkemedelsindustrin och branschföreningarna LIF och FGL genom att skicka ut frågor om bland annat ersättning för att tillhandahålla ett buffertlager av äldre antibiotika och vilka incitament som behövs för att fortsatt marknadsföra dessa produkter i Sverige. Liknande frågor ställdes till läkemedelsindustrin under utvecklingen av ersättningsmodellen för vissa nya antibiotika som tidigare pilottestats av myndigheten. Vi ser att det är viktigt att företagen hålls delaktiga i processen för att förhoppningsvis öka modellens genomförbarhet framgent.
Frågorna skickades till de original- eller generikaföretag som marknadsför systemiska förskrivningsantibiotika på den svenska marknaden som tillhör kategori A eller B på Folkhälsomyndighetens prioriteringslista över antibiotikaprodukter som riskerar eller har bristande tillgänglighet i Sverige, samt till branschföreningarna LIF och FGL. Detta för att samla in synpunkter från marknadstillståndsinnehavare för de produkter som inledningsvis kunde blivit aktuella för ersättningsmodellen innan de finala urvalskriterierna för produkterna var framtagna, samt från deras branschföreningar.
Det varierade mellan de svarande företagen om de föredrog en anpassad, individuell ersättning per produkt eller om de förespråkade en enklare modell med fast ersättning för lagerhållning av produkter. Några betonade också att de ville att antibiotikaprodukterna skulle ha en värdebaserad ersättning.
Företagen har kostnader knutna till den minsta orderkvantiteten som krävs ur produktionssynpunkt, som i vissa fall överstiger marknadens behov. Detta innebär att en stor del av kvantiteten som produceras till Sverige måste destrueras.
Många svarande lyfter problem med låg försäljningsvolym och låga priser för äldre antibiotika, vilket orsakar låg lönsamhet. En låg försäljningsvolym för flera av de äldre antibiotikaprodukterna innebär att de regulatoriska kostnaderna och den administrativa arbetskostnaden blir förhållandevis hög jämfört med en produkt med hög försäljningsvolym.
Flera svarande påpekade att produktionskostnader, logistik- och distributionskostnader samt registrerings- och licenskostnader varierar mellan produkter och även mellan företag. Något företag preciserade ändå några av kostnaderna för att anpassa en produkt för en lokal marknad: årliga regulatoriska kostnader, kvalitetskontroll, distribution och lagerhantering (planering, kostnader för pallplats), kundkontakter (med distributörer och grossister), marknadsanalyser (prissättning), informationsmaterial (instruktionsfilm, patientbroschyr, demoprodukter etcetera).
Tidsåtgången för att bygga upp ett lager för tre månaders förbrukning varierade mellan de svarande företagen, men var tre till tolv månader för produkter som redan finns tillgängliga för försäljning. Däremot blir det längre ledtider för produkter som måste återregistreras.
Generellt förespråkar företagen och branschorganisationerna förutsägbarhet i efterfrågan och betalningar och vill att en modell som säkrar tillgång till antibiotika ska vara just förutsägbar. Detta formulerades till exempel som om ett företag är garanterad en viss inkomst i utbyte mot att hålla en viss lagernivå, så sjunker den affärsmässiga risken och det blir mer attraktivt att delta. I ett sådant upplägg är det också högst rimligt att det finns krav på företaget att visa att det faktiskt finns ett lager i Sverige.
På frågor om sanktioner och viten, svarade någon att en leverantör aldrig väljer att misslyckas med en leverans, utan det är något som händer utanför företagets kontroll. Sanktioner kopplade till faktorer företagen inte själva bestämmer över riskerar att ytterligare avskräcka från en marknad där incitamenten redan idag är små. Någon annan skrev att om staten antingen betalar för de varor som kan komma att kasseras, eller betalar så pass bra att ett företag på förhand kan beräkna andel kassation och därmed ta betalt för detta i sitt överenskomna pris, försvinner förlustrisken för företaget. Det skulle vara möjligt att avtala om vite, till exempel relaterat till levererad volym inom avtalsperioden, säg att om 70 procent levererats kan 30 procent av lagervärdet bli vitesbeloppet.
När det kom till konkreta förslag på kostnadslättnader var flera av de svarande inne på att elektroniska bipacksedlar eller flerspråkiga förpackningar kan underlätta för företagen. Likaså tyckte flera att de kostnader myndigheter tar ut från företagen för ett läkemedel som finns på marknaden i Sverige helt bör slopas för äldre antibiotika.
Vad gäller vilken årlig minimiersättning som skulle vara nödvändig för att behålla eller återregistrera en äldre antibiotikaprodukt, skrev ett företag att för att täcka kostnaderna skulle man behöva en miljon kronor per produkt (substans, beredningsform och styrka) och år. Andra hänvisade till nivån i Folkhälsomyndighetens ersättningsmodell där avtal om tillgänglighet för nya antibiotika med effekt på karbapenemresistenta gramnegativa bakterier tecknats med läkemedelsföretagen.
Folkhälsomyndighetens slutsatser gällande företagens synpunkter
Det är rimligt att läkemedelsföretagen kompenseras för de årliga regulatoriska avgifterna och en del övriga fasta kostnader som inte täcks av försäljningsmarginalen för prioriterade äldre antibiotikaprodukter med låg försäljningsvolym genom exempelvis den föreslagna ersättningsmodellen. Folkhälsomyndigheten ser även problematiken kring kraven på en hög minimiorderkvantitet för vissa produkter. Myndigheten konstaterar samtidigt att läkemedelsföretag, mot en administrativ insats, redan idag kan ansöka om reduktion av årsavgiften hos Läkemedelsverket, för att på så sätt eventuellt minska vissa fasta årliga regulatoriska kostnader.
För produkter med hög försäljningsvolym kommer krav på buffertlager baserat på föregående års förbrukning innebära kostnader för att binda kapital och en affärsrisk för företaget om man inte lyckas sälja lagret. Alla produkter i det föreslagna urvalet har dock en låg försäljning, så risken för förlust av detta skäl bedöms vara liten.
Kriterier och riktlinjer för en ny ersättningsmodell
För att i möjligaste mån förhindra att patienter och sjukvården står utan kritiska äldre antibiotikaprodukter på grund av korta och medellånga bristsituationer eller för att företagen slutar att marknadsföra produkten, föreslår Folkhälsomyndigheten nedanstående modell för upphandling av tillgänglighet till ett nationellt omsättningsbart centralt buffertlager.
Avsikten är att
- i möjligaste mån säkerställa att det ständigt finns ett buffertlager motsvarande cirka tre till sex månaders normalförbrukning av utvalda antibiotikaprodukter hos distributör
- ge berörda läkemedelsföretag incitament och bättre förutsägbarhet för att vilja behålla produkten på marknaden.
- Förslaget innebär att
- alla ingående produkter, oavsett försäljningsvärde, erbjuds en årlig lagerersättning om 400 000 kronor
- för produkter med en årlig försäljning som understiger 850 000 kronor, erbjuds en ytterligare försäljningskompensation upp till denna summa. Ersättningen beräknas enligt formeln: 850 000 – faktisk årlig försäljning (baserat på apotekens inköpspris)
Detta under förutsättning att kraven i avtalet uppfylls. Den årliga lagerersättningen till företagen är villkorad till att företaget kvartalsvis uppvisar att buffertlagrets volym motsvarar minst sex månaders förbrukning. Första fjärdedelen av lagerersättningen garanteras när företaget byggt upp lagervolymen och kan uppvisa att kravet på sex månaders buffertlager hos distributör av den specifika produkten är uppfyllt (definierat som substans, beredningsform och styrka).
Nästa fjärdedel av lagerersättningen garanteras tidigast tre månader senare, när företaget på nytt kan uppvisa att buffertlagrets volym motsvarar minst sex månaders förbrukning. Detta upprepas kvartalsvis och den totala lagerersättningen på ett år kan endast uppgå till den maximala lagerersättningen om 400 000 kronor förutsatt att företaget kvartalsvis kan påvisa att lagret uppfyller volymkraven. Av detta följer att ersättningen till företaget kan utebli för den eventuella tid som de inte rapporterat in att volymen åter motsvarar sex månaders förbrukning, räknat från tidigast tre månader från förra rapporteringen.
Eftersom varje fjärdedel av lagerersättningen är villkorad till att företaget kvartalsvis uppvisar att buffertlagrets volym motsvarar minst sex månaders förbrukning, byggs ett incitament att fylla på lagret in i modellen. Däremot behöver utbetalningen av ersättningen inte nödvändigtvis ske kvartalsvis, utan skulle kunna ske årsvis. Det finns utrymme för att i nästa steg hitta ett lämpligt format för de berörda företagen som också passar myndighetens administration.
Försäljningskompensationen bygger på helårsförsäljning och är också villkorad till att lagervolymerna upprätthållits enligt avtal.
Olika storlekar på buffertlagret och upplägg på ersättningsmodellen har utretts under förstudien. Sex månaders buffertlager valdes dock, eftersom det ger en marginal som täcker en genomsnittlig restsituation på runt fyra månader enligt Läkemedelsverkets data.
I kontakterna med företagen framkom att de flesta företag har några månaders förbrukning på lager, ofta tre, så den totala volymen på lagret om minst sex månader medför samma ökning som ett separat buffertlager med tre månaders förbrukning.
Ersättningsnivå
I förstudien har Folkhälsomyndigheten utrett olika upplägg för ersättningen som läkemedelsföretagen ska få för att tillhandahålla ett centralt buffertlager. Det gäller bland annat principen om en modell med fastställd ersättning per kontraktsperiod som är samma för alla ingående produkter samt en modell där ersättningen är olika för olika produkter baserat på anbud som företagen själva får lämna vid en upphandling.
Ersättningen är tänkt att ge företagen ett rimligt ekonomiskt incitament för att fortsatt marknadsföra och tillhandahålla produkterna på den svenska marknaden. Endast något enstaka företag har gett Folkhälsomyndigheten en indikation på vad de anser är ett rimligt ekonomiskt incitament för denna produktkategori. Vidare har myndigheten förståelse för att det kan variera mycket mellan olika produkter och företag.
Folkhälsomyndigheten har strävat efter att skapa en enkel och förutsägbar modell, och föreslår därför en lagerersättning som är samma oavsett försäljningsvolym och i förekommande fall en försäljningskompensation. Enkelheten i modellen vi pilottestade för nya läkemedel var ett av de element som framhölls som positivt, av både läkemedelsindustrin och andra aktörer.
Baserat på tidigare regeringsuppdrag inklusive erfarenheter från pilotmodellen och övrigt som framkommit under utredningen, föreslår vi att modellen garanterar en årlig lagerersättning om 400 000 kronor per produkt (definierat som substans, beredningsform och styrka), för samtliga ingående produkter, som är frikopplad från produktens försäljning. Dessa 400 000 kronor ska underlätta för företag att fortsatt tillhandahålla produkten på den svenska marknaden och täcka delar av deras kostnader, exempelvis för ökad lagerhållning.
Vidare föreslår vi att produkter med försäljning understigande 850 000 kronor, erbjuds en ytterligare försäljningskompensation som utgörs av mellanskillnaden upp till denna summa. Ersättningen beräknas enligt formeln: 850 000 – faktisk årlig försäljning (baserat på apotekens inköpspris).
Lagerersättningen och försäljningskompensationen erbjuds under förutsättning att företaget uppfyller samtliga krav i avtalet. Se figur 1 nedan för en schematisk bild på den föreslagna årliga ersättningen från modellen och från försäljning.
TLV:s beräkningar av risken för avregistrering inom ett tidigare regeringsuppdrag (21) utgick från försäljningsvärden 2016 och visade att det finns en betydande risk för att en produkt (substans, beredningsform och styrka) försvinner från marknaden vid en årlig försäljning som understiger en miljon kronor per år. Försvinner innebär i detta fall att produkten avregistreras eller att den i praktiken inte tillhandahålls, inte har någon försäljning. För närvarande uppgår den totala årliga försäljningen av de 20 utvalda produkterna till cirka 20,5 miljoner kronor med en median på knappt en miljon kronor.
För en produkt som har en årlig försäljning som understiger 850 000 kronor kan företaget erhålla maximalt 1,25 miljoner kronor, i lagerersättning samt försäljningskompensation (minus den årliga försäljningen för produkten). Nivån på 1,25 miljoner kronor har beräknats konservativt med hänsyn till inflationen från 2016. De utvalda antibiotikaprodukterna ingår i läkemedelsförmånerna inom vilken prissättningen är regelstyrd vilket innebär att det inte på samma sätt som för andra produkter är möjligt att höja priserna för att möta de ökade kostnaderna beroende på exempelvis inflation.
Ersättningsmodellen, likt myndighetens ersättningsmodell för nya antibiotika, avser att inte påverka förskrivningen eller användningen av de ingående antibiotikaprodukterna. Förskrivande öppenvårdsläkare fortsätter att skriva recept som vanligt och apoteken (och regioner/sjukhus samt andra berörda vårdgivare) beställer hem produkter enligt nuvarande rutiner. Eftersom varken läkare eller apotek erhåller någon ekonomisk fördel av att förskriva eller beställa produkterna som ingår i den föreslagna modellen, bedömer vi att det är en minimal risk att produkternas användning påverkas. Det finns dessutom etablerade behandlingsriktlinjer för infektioner i öppenvård för förskrivare att hålla sig till.
Dock är det fortsatt viktigt att följa användningen av de ingående produkterna genom de övervakningsmekanismer som finns vid en eventuell implementering av en pilotstudie av modellen.
Genom det urval myndigheten föreslår ser vi att situationen där flera företag delar på ansvaret och ersättningen för en specifik antibiotikaprodukt sällan kommer att uppstå. Parallellimporterade läkemedel är inte aktuella för denna betalningsmodell i första hand men avses kunna fortsätta marknadsföras som tidigare.
Företagen kan också ansöka till Läkemedelsverket om reducerad eller helt nedsatt årsavgift och därmed ytterligare minska kostnaderna för en viss produkt. Samtliga utvalda prioriterade antibiotikaprodukter ingår i läkemedelsförmånerna och har ett fastställt pris. Således kan företagen också ansöka om prishöjning till TLV som ett led i att öka marginalerna för sin produkt.
Figur 1. Visar schematiskt den totala årliga ersättningen företag kan få för en produkt (substans, beredningsform, styrka), från försäljningen av produkten samt ersättning genom föreslagna modellen.
Dokumentation
Företaget ska inkomma med dokumentation i samband med att lagervolymen motsvarar minst sex månaders förbrukning baserat på föregående års försäljning, distributionskanalerna är på plats och företaget är redo att fullgöra sina förpliktelser enligt avtalet.
Företaget ska vidare kvartalsvis rapportera in att lagervolymen motsvarar minst sex månaders förbrukning baserat på föregående års försäljning för att garanteras det aktuella kvartalets öronmärkta ersättning. Mer detaljerade och eventuellt ytterligare dokumentationskrav på exempelvis leveranser kommer att specificeras inom en eventuell pilotstudie av modellen.
Förpackningsstorlekar
Förpackningsstorleken har betydelse för företag och patienter, men anses av professionen oftast kunna lösas temporärt om rätt formulering och styrka finns.
Även om det ytterst är viktigt med tillgång till substans, beredningsform och styrka så är även tillgång till olika förpackningsstorlekar viktigt. Detta gäller särskilt dessa äldre antibiotikaprodukter som främst expedieras på öppenvårdsapotek, så att patienten inte får med sig en för stor förpackning som kanske sparas och används vid egeninitierade hemmakurer, eller kasseras på felaktigt sätt och därmed riskerar att driva på resistensutvecklingen. För att ta hänsyn till detta föreslår Folkhälsomyndigheten att kravställningen på företag som tecknar avtal om buffertlager ska inkludera att tillhandahålla och lagerföra de förpackningsstorlekar som motsvaras av föregående års förbrukning av specifika förpackningsstorlekar.
Parallellimport
För antibiotikaprodukter där parallellimport förekommer ska företaget basera buffertlagrets faktiska volym på sex månaders försäljning motsvarande originalet eller generikan inklusive försäljningen av samtliga parallellimporter av produkten i fråga.
Parallellimport kommer inte att omfattas av modellen i första hand. Det är i regel ovanligt med parallellimport för äldre olönsamma produkter. Därtill kan dessa produkter inte heller anses vara långsiktigt och kontinuerligt tillgängliga på marknaden så som generika och originalprodukter, eftersom de köps och säljs i tillfälliga partier. Vid ett eventuellt avtalstecknande ska original- och generikaföretag prioriteras i första hand, medan parallellimportörer endast kan ha möjlighet att teckna avtal i sista hand.
Produkter inom periodens vara-systemet ska inte omfattas av modellen
Endast antibiotikaprodukter som inte ingår i periodens vara-systemet föreslås ingå i modellen. Produkter inom periodens vara-systemet är föremål för generisk konkurrens, vilket innebär att minst två marknadstillståndsinnehavare tillhandahåller utbytbara produkter med olika godkännanden med samma substans, beredningsform och styrka. Folkhälsomyndigheten avser att inte påverka den befintliga marknaden, prissättningen eller läkemedelsförmånssystemet med den föreslagna ersättningsmodellen. Både tillgängligheten till ett buffertlager och själva ersättningen till företagen riskerar dock potentiellt att snedvrida konkurrensen inom systemet, eftersom det finns både en tillhandahållandekomponent och en priskomponent kopplat till en produkt som blir periodens vara i en utbytesgrupp. Vidare har tidigare analyser visat ett tydligt samband mellan försäljningsvärde och risken att en produkt (definierat som substans, beredningsform och styrka) försvann från marknaden om företagets intäkt var under 1 miljon kronor i apotekens inköpspris per år. Endast tre antibiotikaprodukter inom periodens vara-systemet hade en försäljning under 1 miljon kronor i apotekens inköpspris per år, enligt en analys inom det tidigare uppdraget om tillgång till äldre antibiotika (S2021/06172) (9). Det är också en anledning att i detta skede rikta ersättningsmodellen till äldre produkter som inte ingår i periodens vara-systemet.
Dessutom finns andra åtgärder som är inriktade på att stärka tillgången till antibiotika inom periodens vara-systemet, såsom TLV:s nyligen genomförda höjningar av takpriser där många utbytesgrupper med antibiotika omfattades samt TLV:s pågående uppdrag om en fördjupad analys av takprissystemet avseende reglering för antibiotika. TLV:s uppdrag om omsättningslager omfattar inte heller läkemedel som ingår i periodens vara-systemet.
Marknaden för äldre antibiotika som saknar marknadsskydd kan ständigt förändras med nya produkter som tillkommer eller försvinner. Det innebär att samtliga produkter som för närvarande ingår i urvalet teoretiskt sett varje månad kan bli föremål för generisk konkurrens och bilda en ny utbytesgrupp på periodens vara-listan om utbytbara produkter med samma substans, beredningsform och styrka får läkemedelsförmån. Därmed finns ett behov av att kunna säga upp eller omförhandla eventuella avtal, för att säkerställa att alla antibiotikaprodukter som omfattas av ersättningsmodellen uppfyller kraven för urval. Detta innebär att Folkhälsomyndigheten på månadsbasis bör bevaka om generisk konkurrens uppstått för någon av de ingående antibiotikaprodukterna, så att en ny utbytesgrupp tillkommit på listan över periodens varor, och i så fall ha möjlighet att säga upp avtalet. I samband med en eventuell kommande pilotstudie kommer detta att utredas och definieras närmare, bland annat i relation till ersättningen.
Övriga krav på de ingående företagen för medverkan
Företaget ska ha erfarenhet av att leverera tjänster till den svenska eller europeiska marknaden och ska visa att det har den yrkesmässiga kapacitet som krävs för att leverera antibiotika samt utföra efterfrågade tjänster avseende bland annat lager och rapportering.
Förslag på upphandlingsförfarande
Genom förstudien har Folkhälsomyndigheten utrett hur upphandling av tillgänglighet till ett definierat buffertlager av äldre antibiotika skulle kunna utformas genom LOU.
Tillgången till ett buffertlager av de äldre utvalda antibiotika föreslår vi upphandlas genom en öppen upphandling för företag som marknadsför definierade produkter utifrån substans, beredningsform och styrka. Något annat förfarande, exempelvis förhandlat förfarande, bedöms inte vara lämpligt i detta fall.
Beröringspunkter och olikheter med andra initiativ gällande nationella omsättningslager
Under uppdraget har Folkhälsomyndigheten haft flera dialogmöten med TLV. TLV har flera regeringsuppdrag som har beröringspunkter med detta uppdrag, bland annat ett om att utreda frågor om omsättningslagring av vissa läkemedel (12). TLV ska inom sitt uppdrag analysera och lämna ändamålsenliga och kostnadseffektiva förslag på hur innehavare av godkännande för försäljning av läkemedel bör kompenseras för ökade kostnader om en lagstadgad skyldighet att lagerhålla vissa läkemedel införs (ett sådant lagförslag finns för närvarande).
TLV:s uppdrag skiljer sig dock från Folkhälsomyndighetens i flera aspekter. Bland annat fokuserar det på många fler läkemedelsprodukter än enbart antibiotika, ersättningen avser inte att ge ekonomiska incitament till företagen och ersättningen är tänkt att regleras genom författningsändringar inom ramen för lagförslaget och inte via LOU.
Läkemedlen i TLV:s uppdrag är också sådana som har en god vardagsförsörjning, och inte produkter med väldigt låg försäljning som i Folkhälsomyndighetens uppdrag. Utgångspunkten för TLV:s arbete är den lista över läkemedel som behövs för vård som inte kan anstå som Socialstyrelsen presenterade den 12 maj 2023 (S2022/04550) (18). Vilka läkemedel som kommer att ingå beror dock på hur avgränsningen görs och vilka gränsvärden som används vilket TLV ska utreda inom uppdraget. Vi avser att fortsatt ha dialog med TLV för att kunna vidta lämpliga åtgärder om det uppstår några överlapp mellan de utvalda antibiotikaprodukterna inom detta uppdrag och TLV:s uppdrag. Läkemedlen i TLV:s föreslagna omsättningslagring kommer också att hållas på nationell nivå inom den normala distributionskedjan.
TLV:s uppdrag ska rapporteras sommaren 2024, och vi ser att det är viktigt att följa detta och eventuellt inkludera vissa slutsatser från det arbetet i vår föreslagna modell i ett senare skede samt hitta synergier att bygga vidare på.
SKR och regeringen träffade en överenskommelse sommaren 2023 inom vilken regionerna tilldelas 400 miljoner kronor för att säkerställa regional tillgång till prioriterade slutenvårdsläkemedel och de medicintekniska produkter som är nödvändiga för att administrera läkemedlen för minst en månads förbrukning. Utgångspunkten för regionernas prioritering är Socialstyrelsens lista över läkemedel som behövs för vård som inte kan anstå (18). Överenskommelsen syftar till en ökad lagerhållning av läkemedel och en god försörjningsberedskap på regional nivå och avser till skillnad från detta uppdrag endast sjukhusprodukter på en annan nivå i försörjningskedjan. Överenskommelsen avser inte att erbjuda ett särskilt ekonomiskt incitament till läkemedelsföretagen för den ökade lagerhållningen och fokuserar inte specifikt på antibiotika. Eventuella överlapp med antibiotikaprodukter som omfattas av detta uppdrag bedöms som liten, men myndigheten avser att följa regionernas arbete på detta område.
Folkhälsomyndighetens modell måste innehålla möjligheten att vidta åtgärder om ytterligare nationella centrala lager läggs upp på samma nivå i försörjningskedjan av de utvalda antibiotikaprodukterna som omfattas av denna ersättningsmodell, exempelvis på grund av en lagstadgad skyldighet. Detta potentiella scenario ligger sannolikt längre fram i tiden. I så fall kan myndighetens upphandlade tillgänglighet till buffertlager av de berörda produkterna troligtvis avvecklas, men det extra ekonomiska incitamentet bör kvarstå i någon form. Hur detta incitament kan utformas bör då utredas vidare.
Juridiska förutsättningar för den föreslagna modellen
Folkhälsomyndigheten har utrett ersättningsmodellen i relation till lagen (2016:1145) om offentlig upphandling (LOU) och bedömer att modellens principer faller inom ramen för denna.
EU:s regler för statligt stöd sätter ramarna för medlemsstaternas möjligheter att med offentliga medel kunna stödja en viss verksamhet. Reglerna finns i artiklarna 107–109 i Fördraget om Europeiska unionens funktionssätt. Där fastställs att statsstöd är förbjudet om det inte uppfyller vissa på förhand bestämda undantag. Syftet med reglerna är att se till att konkurrensen på EU:s inre marknad inte snedvrids. Folkhälsomyndigheten har inför den tidigare pilotstudien (S2018/03920) bedömt att den ersättningsmodell som myndigheten utarbetade för nya antibiotika inte innebar otillåtligt statsstöd. Denna modell för buffertlager skiljer sig dock på ett antal punkter, men främst urvalet av antibiotikaprodukter och fördelningen av ersättningen. Vår bedömning baserat på utredningen inom det tidigare uppdraget är dock fortsatt att den föreslagna modellen inte innebär otillåtligt statsstöd.
Ekonomiska konsekvenser av den föreslagna modellen
Den totala kostnaden för det offentliga utgör cirka 17 miljoner kronor, vilket omfattar ersättningen från modellen och personella resurser. Nedan beskrivs kostnaderna närmare.
Den årliga lager ersättningen om 400 000 kronor per produkt, fördelas kvartalsvis mot att buffertlagrets volym motsvarar minst sex månaders normalförbrukning, och försäljningskompensationen om 850 000 kronor bygger på helårsförsäljning och är också villkorad till att lagervolymerna upprätthållits enligt avtal. Den föreslagna urvalsprocessen av äldre antibiotika med risk för bristande tillgänglighet på den svenska marknaden resulterade i 20 prioriterade förstahandsalternativ vid vanliga infektioner i öppenvården, inklusive tuberkulos, att potentiellt teckna avtal om tillgänglighet för.
Ersättningen från modellen uppgår i en total kostnad om 15 miljoner kronor från den tidpunkt då avtalets villkor uppfyllts av alla ingående parter för samtliga antibiotikaprodukter under förutsättning att det lämnas anbud för samtliga antibiotikaprodukter inom en kommande upphandling.
Den uppskattade totala årliga kostnaden för den fasta ersättningen är 8 miljoner kronor för samtliga 20 urvalsprodukter.
Ungefär hälften av de utvalda produkterna hade en årlig försäljning som understeg 850 000 kronor år 2022, vilket resulterar i en årlig kostnad på cirka 7 miljoner kronor för modellen för att ersätta försäljningskompensationen upp till 850 000 kronor.
Under myndighetens pilotstudie där tillgänglighet till fem nya antibiotika upphandlades var motsvarande kostnad cirka 10 miljoner kronor totalt per år, eller 2 miljoner per produkt och år. I den nu aktuella modellen berörs en betydligt större patientgrupp, och att säkerställa tillgång till prioriterade äldre antibiotika handlar främst om att begränsa biverkningar, resistensutveckling och de alternativa kostnader som uppstår för samhället vid bristsituationer, till exempel att brister på perorala alternativ kan leda till att barn läggs in på sjukhus för att få intravenös behandling.
Till skillnad från det nu aktuella uppdraget möjliggör myndighetens andra pågående uppdrag, om att säkerställa tillgänglighet till medicinskt viktiga nya antibiotika, en livräddande behandling till en mycket begränsad, svårt sjuk, patientgrupp.
Arbetet med att genomföra en pilotstudie för att testa ersättningsmodellen i praktiken, inklusive utvärdering och uppföljning, beräknas ta personella resurser i anspråk, uppskattningsvis motsvarande drygt en årlig heltidstjänst till en kostnad av 2 miljoner kronor, innefattande kompetenser inom projektledning, farmaci, hälsoekonomi, infektionsmedicin, juridik, mikrobiologi och upphandling.
Möjligheter och utmaningar för samarbete och samverkan med nordiska länder om stärkt tillgång till äldre antibiotika
Nedan redovisar vi en sammanställning av Norges, Danmarks och Finlands inspel till Folkhälsomyndigheten, som framkommit i svar på ett antal frågor och i dialog, om möjligheten till samarbete eller samordning mellan de nordiska länderna om en ersättningsmodell för äldre antibiotika.
Finland och Norge har redan etablerade omsättningsbara buffertlager av utvalda läkemedel, inklusive vissa antibiotika, för minst sex månaders förbrukning.
Läkemedelsföretagen anser generellt att förutom priset på produkten och försäljningsvolymen är förutsägbarhet på marknaden den viktigaste faktorn vid beslut om marknadsföring av en produkt. En stor gemensam marknad skulle alltså vara en fördel när det gäller ”små” produkter. Detta kanske även kan medföra miljömässiga fördelar som mindre kassation av utgångna produkter.
Det finns dock flera utmaningar. I första hand behövs en samordning av formuleringar, styrkor och förpackningsstorlekar mellan de nordiska länderna, vilket bäst skulle kunna realiseras om behandlingsrekommendationer harmoniseras i Norden, något som tidigare visats vara svårt men inte omöjligt att genomföra. En starkare nationell, helst nordisk, styrning av behandlingsrekommendationer efterlystes av flera svarande länder.
Ett konsekvent genomförande av samnordiska texter eller elektroniska bipacksedlar lyftes också som mycket önskvärt. Vidare ansågs det nästan vara en förutsättning att länderna har en eller flera gemensamma marknadsbolag per substans. Om inte befarades stora logistiska svårigheter. Man varnar också för att ett snabbt uppbyggande av större lager kan leda till allvarliga bristsituationer. Man påpekade även risken för att nationell lagstiftning och nationella intressen vid kommande kriser kan försvåra solidariteten kring att fördela medicinskt viktiga produkter mellan de nordiska länderna.
Förslag på tillvägagångssätt för att stärka tillgängligheten till prioriterade äldre antibiotika betonade vikten av ett fortsatt gott och ökat samarbete mellan länderna och att kunna underlätta förflyttning av produkter mellan länderna vid behov. Varje land bör då betala ett rimligt värde för flyttade produkter. Ansvaret för tillgänglighet till antibiotika (och andra läkemedel) verkar vara mycket fragmenterat mellan olika myndigheter inom och mellan våra länder. En starkare nationell styrning skulle kunna underlätta ett tydligt och effektivt beslutsfattande. En politisk, helst samnordisk, överenskommelse på hög nivå om lokalisation och villkor för ett eventuellt gemensamt buffertlager, är en förutsättning för att kunna implementera ett ändamålsenligt nordiskt omsättningslager av utvalda prioriterade antibiotikaprodukter. En bindande överenskommelse baserad på principer för nationellt ansvar och fördelning av produkter mellan de deltagande länderna är önskvärd. Tidigare fanns ett gemensamt skandinaviskt virtuellt lager av antitoxiner, som borde kunna dras lärdom av inför ett eventuellt nordiskt samarbete om tillgång till äldre antibiotika.
Konkreta förslag var att erbjuda en fast ersättning kombinerat med definierade krav på tillgänglighet. Den svenska pilotstudien för ökad tillgänglighet till nya medicinskt viktiga antibiotika gavs som exempel. Ersättningen skulle kunna erbjudas tillverkaren som sedan ansvarar för leveranskedjan, till exempel nationella ”leverantörer” levererar enligt avtal. Även betydelsen av att se över takpriser för dessa äldre ofta lågt prissatta produkter lyftes. Man föreslog också en utredning av förutsättningarna för en gemensam samordnad upphandling med alla eller delar av de nordiska länderna. Detta kan komma att kräva förändringar i förordningar och skulle kunna fördelas över flera leverantörer för att motverka att företag lämnar marknaden. Det försvåras av nuvarande skillnader i de olika ländernas praxis för upphandling, regionalt eller nationellt.
Samtliga länder ansåg det viktigt att bevaka pågående internationella, europeiska och nationella aktiviteter som är av intresse för att stärka tillgängligheten till medicinskt viktiga äldre antibiotika. Aktiviteter som nämndes:
- EU Critical Medicines list (ema.europe.eu)
- EU vulnerability analysis of supply chains of these medicines (ec.europa.eu)
- Tidigare HERA AMR feasibility study: EU Medical Counter Measures and RescEU for CBRN MCMs (europa.eu.en)
- EU-JAMRAI 2, work-package 9 – Improving access to important and vulnerable antibiotics and diagnostics, som leds av Norge och Sverige (genom Folkhälsomyndigheten) med start i januari 2024
Svaren betonade starkt vikte n av att följa dessa initiativ och hur en nordisk strategi för att öka tillgängligheten till medicinskt viktiga antibiotika kan anpassas till och samordnas med dessa.
Folkhälsomyndighetens bedömning av möjligheter och utmaningar för nordiskt samarbete och samverkan på området
Folkhälsomyndigheten bedömer att det är viktigt att myndigheten fortsatt följer och bidrar med erfarenheter till arbetet på nordisk nivå, men konstaterar samtidigt att de nordiska länderna har kommit olika långt i att bygga upp buffertlager. Finland och Norge har redan etablerade nationella läkemedelslager där vissa antibiotika ingår.
Myndigheten bedömer att en eventuell gemensam upphandling av tillgänglighet till ett nordiskt buffertlager av äldre antibiotikaprodukter ligger längre fram i tiden då vissa förutsättningar behöver finnas på plats.
Förutsättningarna för att bättre kunna stärka marknaden för prioriterade äldre antibiotikaprodukter i de nordiska länderna bedöms av Folkhälsomyndigheten främst kunna ske genom att se över rådande nationella behandlingsrekommendationer och om möjligt harmonisera dessa i en nordisk kontext och på så vis skapa en större marknad för produkterna. De nordiska länderna har alla en relativt god resistenssituation och därmed tradition att i första hand använda smalspektrumantibiotika och en harmonisering av behandlingsrekommendationer för dessa preparat torde kunna vara möjlig. En pågående kartläggning av den nordiska antibiotikamarknaden som utförs av samverkansplattformen PLATINEA visar preliminärt på en mycket diversifierad marknad med ett stort antal olika men nästan samma styrkor och förpackningsstorlekar, marknadsförda av ett stort antal läkemedelsföretag, vilket medför en mycket splittrad och sårbar marknad. Det framgår även tydligt att Norge, som är en ännu mindre marknad än Sverige, har förlorat flera viktiga äldre antibiotikaprodukter de senaste åren, främst märkbart avseende barnberedningar, vilket tolkats vara en följd av låg lönsamhet. Detta har varit en bidragande orsak till att man nu byggt upp ett statligt ägt buffertlager av medicinskt viktiga läkemedel. PLATINEA:s kartläggning kommer att redovisas i rapporten av Folkhälsomyndighetens uppdrag att ta fram ett underlag till den nordiska hälsoministerdiskussionen 2024 om ett nordiskt samarbete om bättre och hållbar tillgång till antibiotika (uppdrag ur regleringsbrevet 2023: nr 18) (22).
Vid en eventuell framtida gemensam upphandling av tillgänglighet till antibiotika anser Folkhälsomyndigheten att det kan vara värdefullt att dra lärdomar från de EU-gemensamma avtalen om covid-19-vaccin.
Folkhälsomyndigheten bedömer att en önskvärd åtgärd som regulatoriska myndigheter kan göra vore att godkänna flerspråkiga förpackningar, för vissa antibiotika och att dessa förpackningar kan användas i flera länder med elektronisk bipacksedel. Ett införande av nordisk märkning av bipacksedlar alternativt elektronisk märkning bedöms vara viktigt för att underlätta för företagen och ge förutsättningar att dela och flytta produkter mellan länderna när det behövs.
Utmaningar för en ökad nordisk samverkan bedöms vara avsaknad av en samnordisk styrning av behandlingsrekommendationer samt av nationella regulatoriska krav. Det finns även risk för att en snabb uppbyggnad av stora nationella eller nordiska buffertlager temporärt kan resultera i allvarliga bristsituationer, samt att en alltför stark styrning mot en harmoniserad antibiotikamarknad oavsiktligt kan medföra att marknaden blir ännu mer sårbar om företag drar sig ur.
Många av de beskrivna åtgärderna ligger inte inom Folkhälsomyndighetens ansvarsområde i första hand, men ingår i arbeten och uppdrag som utförs av andra myndigheter och aktörer.
Folkhälsomyndighetens förslag
Som ett resultat av denna förstudie föreslår Folkhälsomyndigheten en ersättningsmodell för att tillgängliggöra ett omsättningsbart nationellt buffertlager om sex månader. Buffertlagret föreslås omfatta 20 äldre antibiotikaprodukter som utgör prioriterade förstahandsalternativ vid vanliga infektioner. Produkterna riskerar bristande tillgänglighet på den svenska marknaden och har valts ut genom urvalsprocessen framtagen i förstudien.
Myndigheten föreslår vidare en årlig lagerersättning på 400 000 kronor per produkt definierat som substans, beredningsform och styrka. För produkter med en årlig försäljning understigande 850 000 kronor, föreslås att ytterligare försäljningskompensation upp till denna summa erbjuds.
Regeringen föreslås slutligen ge Folkhälsomyndigheten i uppdrag att testa och implementera den utredda ersättningsmodellen i en pilotstudie, och att medel tillskjuts för detta för att upphandla tillgänglighet till ett buffertlager samt bekosta personella resurser hos Folkhälsomyndigheten för det fortsatta arbetet.
Diskussion
Många äldre antibiotikaprodukter som sedan länge förlorat sitt marknadsskydd har låg lönsamhet och säljs i låga volymer, med en fallande trend över lång tid. Den svenska läkemedelsmarknaden är liten i ett internationellt perspektiv och till följd av en restriktiv användning gäller det i hög grad antibiotikamarknaden.
Vidare finns en risk för avregistreringar och återkommande problem med rest- och bristsituationer. Det behövs åtgärder för att stärka tillgängligheten och ta höjd för rest- och bristsituationer för de äldre antibiotikaprodukter med stor risk för bristande tillgänglighet som identifieras få de största kliniska konsekvenserna om de inte finns tillgängliga.
Inom detta uppdrag har Folkhälsomyndigheten genomfört en förstudie av en modell för att ge företag ersättning för att tillhandahålla ett buffertlager av prioriterade äldre antibiotika. Myndigheten har tagit fram en urvalsprocess som resulterat i 20 prioriterade äldre öppenvårdsantibiotika med risk för bristande tillgänglighet på den svenska marknaden, som är förstahandsval vid vanliga infektioner i öppenvården och vid tuberkulos, och som inkluderar främst inte utbytbara produkter och pediatriska formuleringar och där majoriteten haft en restsituation de senaste 5 åren med en mediantid på över 70 dagar.
Buffertlagret har två primära syften. Det ska dels användas vid och motverka korta och medellånga brister, dels ge ett särskilt ekonomiskt incitament till företagen för att behålla dessa produkter på den svenska marknaden. Det är alltså en modell för att bibehålla tillgång till prioriterade äldre antibiotika som riskerar att avregistreras på grund av främst dålig lönsamhet.
En ökad lagerhållning av läkemedel innefattas av de andra pågående nationella aktiviteter som syftar till att bygga upp försörjningsberedskapen på olika nivåer i kedjan. En ökad lagerhållning av vissa läkemedel går i linje med det första syftet med ett buffertlager av äldre antibiotika, det vill säga att användas vid korta och medellånga restsituationer. Dock erbjuder inga av dessa initiativ ett ekonomiskt incitament till företag att fortsatt tillhandahålla äldre antibiotikaprodukter på den svenska marknaden så som denna ersättningsmodell gör. Krav på lagerhållning utan ett ekonomiskt incitament löser inte de problem med stor risk för bristande tillgänglighet eller avregistrering som vi ser för dessa prioriterade äldre förstahandsantibiotika.
Folkhälsomyndigheten konstaterar också att det är lång tid kvar innan andra beskrivna initiativ blir verklighet och eventuellt implementeras, och anser att det är angeläget att agera snarast på detta område för att minska risken att produkter försvinner från den svenska marknaden. Inte minst med tanke på den nuvarande problematiken med restsituationer. Mot bakgrund av det som framkommit i denna förstudie rekommenderar vi att de grundprinciper och kriterier som tagits fram inom detta uppdrag bör fortsätta utvecklas, implementeras och utvärderas inom ramen för en pilotstudie, i likhet med pilotstudien av den ersättningsmodell som myndigheten utvecklat för nya antibiotika. Vidare ser vi ett behov av en särskild ekonomisk satsning i fråga om äldre antibiotika, precis som regeringen konstaterar i beskrivningen av detta regeringsuppdrag. En pilotmodell bedöms rimlig och genomförbar ur både ett ekonomiskt och juridiskt perspektiv.
En pilotstudie i närtid för att successivt påbörja uppbyggnaden och säkra nationell tillgång till ett buffertlager av dessa prioriterade äldre förstahandspreparat är också av betydelse för att undvika att flera buffertlager av produkterna ska läggas upp samtidigt, vilket i sig kan riskera att orsaka allvarliga bristsituationer.
Referenser
- Läkemedelsverket. Statistik om restsituationer [Internet]. Uppsala: Läkemedelsverket; 2020 [uppdaterad 2024-01-19; citerad 2024-01-22] Hämtad från: https://www.lakemedelsverket.se/sv/behandling-och-forskrivning/forskrivning/restsituationer/statistik-om-restsituationer#hmainbody2
- Folkhälsomyndigheten och Jordbruksverket. Tvärsektoriell handlingsplan mot antibiotikaresistens 2021–2024 – Underlag för samverkansgruppens fortsatta arbete [Internet]. Solna: Folkhälsomyndigheten; 2021. [citerad 23-10-16]. Hämtad från: https://www.folkhalsomyndigheten.se/publikationer-och-material/publikationsarkiv/t/tvarsektoriell-handlingsplan-mot-antibiotikaresistens-20212024/
- Regeringskansliet. Regeringens nationella strategi för arbetet mot antibiotikaresistens 2024-2025 [Internet]. Stockholm; Socialdepartementet; 2023. [citerad 23-10-16]. Hämtad från: https://www.regeringen.se/contentassets/6af6006cac97425180a8d86d5242d510/svensk-strategi-for-arbetet-mot-antibiotikaresistens-ny.pdf
- Europeiska kommissionen. A European One Health Action Plan against Antimicrobial Resistance (AMR) [Internet]. Bryssel; Europeiska kommissionen; 2017. [citerad 23-10-16]. Hämtad från: https://health.ec.europa.eu/system/files/2020-01/amr_2017_action-plan_0.pdf
- Directorate-General for Health and Food Safety. Council Recommendation on stepping up EU actions to combat antimicrobial resistance in a One Health approach [Internet]. Bryssel; Europeiska kommissionen; 2023. [citerad 23-10-16]. Hämtad från: https://health.ec.europa.eu/publications/council-recommendation-stepping-eu-actions-combat-antimicrobial-resistance-one-health-approach_en?prefLang=sv
- Europeiska kommissionen. Reform of the EU pharmaceutical legislation [Internet]. Bryssel: Europeiska kommissionen; 2023. [citerad 23-10-16]. Hämtad från: https://health.ec.europa.eu/medicinal-products/pharmaceutical-strategy-europe/reform-eu-pharmaceutical-legislation_en?prefLang=sv
- Regeringskansliet. Nationell läkemedelsstrategi 2024–2026 [Internet]. Stockholm; Socialdepartementet; 2024. [citerad 24-02-08]. Hämtad från: https://www.regeringen.se/contentassets/7fffd4ff497147b38bf242914080cfec/lakemedelsstrategin-final.pdf
- M., Panteli D., och Mossialos E.. How can the EU support sustainable innovation and access to effective antibiotics? Policy options for existing and new medicines [Internet]. Köpenhamn: European Observatory on Health Systems and Policies; 2023; 51. [citerad 2023-10-17]. Hämtad från: https://www.ncbi.nlm.nih.gov/books/NBK594073/
- Folkhälsomyndigheten, Tandvårds-och Läkemedelsförmånsverket, Läkemedelsverket. Uppdrag att stärka tillgången till äldre antibiotika – kartläggning och förslag på åtgärder [Internet]. Stockholm: Tandvårds – och läkemedelsförmånsverket; 2023. [citerad 2023-10-17]. Hämtad från: https://www.tlv.se/download/18.5e8c1abc18461f354fbec5b/1672233413137/uppdrag_att_starka_tillgangen_till_aldre_antibiotika_slutrapport.pdf
- Folkhälsomyndigheten. Tillgänglighet till vissa antibiotika – Slutrapport från en pilotstudie av en alternativ ersättningsmodell [Internet]. Solna: Folkhälsomyndigheten; 2023. [uppdaterad 2023-05-31; citerad 2023-10-17] Hämtad från: https://www.folkhalsomyndigheten.se/publikationer-och-material/publikationsarkiv/t/tillganglighet-till-vissa-antibiotika-slutrapport-fran-en-pilotstudie-av-en-alternativ-ersattningsmodell/
- Regeringskansliet. Uppdrag att fortsatt öka tillgängligheten till vissa antibiotika [Internet]. Stockholm: Socialdepartementet; 2023 [uppdaterad 2023-05-24; citerad 2023-10-20]. Hämtad från: https://www.regeringen.se/regeringsuppdrag/2023/05/pressmeddelande-ersattningsgaranti-okar-tillgangen-till-viktiga-antibiotika/
- Tandvårds- och läkemedelsförmånsverket. TLV får i uppdrag att utreda frågor om omsättningslagring av vissa läkemedel för att säkerställa en god försörjningsberedskap [Internet]. Stockholm; Tandvårds- och läkemedelsförmånsverket; 2023 [uppdaterad 2023-06-26; citerad 2023-10-20]. Hämtad från: https://www.tlv.se/press/nyheter/arkiv/2023-06-26-tlv-far-i-uppdrag-att-utreda-fragor-om-omsattningslagring-av-vissa-lakemedel-for-att-sakerstalla-en-god-forsorjningsberedskap.html
- Tandvårds- och läkemedelsförmånsverket. TLV får i uppdrag att genomföra en fördjupad analys av takprissystemet avseende reglering för antibiotika [Internet]. Stockholm; Tandvårds- och läkemedelsförmånsverket; 2023 [uppdaterad 2023-06-30; citerad 2023-10-20]. Hämtad från: https://www.tlv.se/press/nyheter/arkiv/2023-06-30-tlv-far-i-uppdrag-att-genomfora-en-fordjupad-analys-av-takprissystemet-avseende-reglering-for-antibiotika.html
- Tandvårds- och läkemedelsförmånsverket. Regeringsuppdrag, Fortsätta utveckla försöksverksamhet för en miljöpremie i läkemedelsförmånssystemet [Internet]. Stockholm; Tandvårds- och läkemedelsförmånsverket; 2023 [uppdaterad 2024-02-06; citerad 2023-10-20]. Hämtad från: https://www.tlv.se/om-tlv/regeringsuppdrag.html
- Läkemedelsverket. Läkemedelsverkets uppdrag [Internet]. Uppsala; Läkemedelsverket; 2019 [uppdaterad 2023-12-29; citerad 2023-10-20]. Hämtad från: https://www.lakemedelsverket.se/sv/om-lakemedelsverket/uppdrag#hmainbody1
- Läkemedelsverket. Läkemedelsverkets uppdrag, Uppdrag att förebygga och hantera rest- och bristsituationer avseende läkemedel [Internet]. Uppsala; Läkemedelsverket; 2020 [uppdaterad 2023-04-21; citerad 2023-10-20]. Hämtad från: https://www.lakemedelsverket.se/sv/om-lakemedelsverket/uppdrag#hmainbody1
- Sjukehusapoteka Vest. Nasjonalt legemiddelberedskapslager [Internet]. Bergen; Sjukehusapoteka Vest; 2019 [uppdaterad 2023-12-29; citerad 2023-10-20]. Hämtad från: https://www.sjukehusapoteka-vest.no/fag-og-forsking/nasjonalt-beredskapslager
- Socialstyrelsen. Underlag för beredskapslagring av läkemedel och vissa förbrukningsartiklar [Internet]. Stockholm: Socialstyrelsen; 2023. [citerad 2023-10-20]. Hämtad från: https://www.socialstyrelsen.se/globalassets/sharepoint-dokument/artikelkatalog/ovrigt/2023-5-8526.pdf
- Regeringskansliet och Sveriges kommuner och regioner. Överenskommelse om försörjningsberedskap för läkemedel mellan staten och Sveriges Kommuner och Regioner [Internet]. Stockholm: Regeringskansliet och Sveriges kommuner och regioner; 2023. [citerad 2023-10-20]. Hämtad från: https://skr.se/download/18.c83ba1818d7896b085137f/1707135427675/Overenskommelse-Halso-och-sjukvardens-arbete-m-civilt-forsvar-2024.pdf
- Socialdepartementet. En stärkt försörjningsberedskap för hälso- och sjukvården (SOU 2021:19) [Internet]. Stockholm: Socialdepartementet [citerad 2023-10-20]. Hämtad från: https://www.regeringen.se/rattsliga-dokument/statens-offentliga-utredningar/2021/03/sou-202119/
- Tandvårds- och läkemedelsförmånsverket. Tillgänglighet till antibiotika Delrapport 2: Ekonomiska ersättningsmodeller för nya antibiotika samt äldre förskrivningsantibiotika. [Internet]. Stockholm; Tandvårds- och läkemedelsförmånsverket; 2017. [citerad 2023-11-08]. Hämtad från: https://www.tlv.se/download/18.36e5d52515ff45d25e39ec8a/1512121229637/delrapport_2_tillganglighet_antibiotika.pdf
- Socialdepartementet. Regleringsbrev för budgetåret 2023 avseende Folkhälsomyndigheten [Internet]. Stockholm: Regeringen; 2023. [citerad 2023-11-08]. Hämtad från: https://www.esv.se/statsliggaren/regleringsbrev/Index?rbId=24334
